华泰联合证券有限责任公司
关于北京奥赛康药业股份有限公司发行股份及支付现金购买资产交易
之独立财务顾问报告
(二次修订稿)
独立财务顾问
出具日期:二〇二一年十月
2-2-1
声明和承诺
华泰联合证券有限责任公司(以下简称“华泰联合证券”或“独立财务顾问”)接受北京奥赛康药业股份有限公司(以下简称“奥赛康”、“上市公司”或“公司”)的委托,担任本次发行股份及支付现金购买资产交易的独立财务顾问,就该事项向奥赛康全体股东提供独立意见,并制作本独立财务顾问报告。
本独立财务顾问报告是依据《中华人民共和国公司法》《中华人民共和国证券法》《上市公司重大资产重组管理办法》《上市公司并购重组财务顾问业务管理办法》《公开发行证券的公司信息披露内容与格式准则第26号——上市公司重大资产重组申请文件》《关于规范上市公司重大资产重组若干问题的规定》等相关法律法规的规定,按照证券行业公认的业务标准、道德规范和诚实信用、勤勉尽责精神,经审慎尽职调查后出具的,旨在对本次交易作出独立、客观和公正的评价,以供奥赛康全体股东及有关方面参考。
一、独立财务顾问声明
1、本独立财务顾问报告所依据的文件和材料由本次交易各方提供,提供方对所提供文件及资料的真实性、准确性和完整性负责,并保证该等信息不存在虚假记载、误导性陈述或者重大遗漏。本独立财务顾问不承担由此引起的任何风险责任。
2、本独立财务顾问报告是基于本次交易各方均按相关协议的条款和承诺全面履行其所有义务的基础而提出的。
3、本独立财务顾问报告不构成对上市公司的任何投资建议,对投资者根据本独立财务顾问报告所作出的任何投资决策可能产生的风险,本独立财务顾问不承担任何责任。
4、本独立财务顾问报告仅作本次重组报告书附件用途,未经本独立财务顾问书面同意,本核查意见不得被用于其他任何目的,也不得被任何第三方使用。
5、本独立财务顾问与本次交易所涉及的各方无其他利益关系,就本次交易所发表的有关意见是完全独立进行的。
6、本独立财务顾问未委托和授权任何其它机构和个人提供未在本独立财务
2-2-2
顾问核查意见中列载的信息和对本核查意见做任何解释或者说明。
7、本独立财务顾问提请上市公司的全体股东和广大投资者认真阅读上市公司董事会发布的《北京奥赛康药业股份有限公司发行股份及支付现金购买资产交易报告书》,并查阅有关备查文件。
二、独立财务顾问承诺
根据《重组管理办法》《准则第26号》《财务顾问业务管理办法》《上市规则》等法律、法规及规范性文件的规定,华泰联合证券出具本独立财务顾问核查意见,并作出如下承诺:
1、本独立财务顾问已履行了本阶段必要的尽职调查义务,在此基础上有理由确信所发表的专业意见与上市公司和交易对方披露的文件内容不存在实质性差异;
2、本独立财务顾问已对上市公司和交易对方披露的本次交易的相关文件进行必要核查,确信披露文件的内容与格式符合要求;
3、基于本阶段的尽职调查,本独立财务顾问有理由确信上市公司委托本独立财务顾问出具核查意见的交易方案符合法律、法规和中国证监会及证券交易所的相关规定,基于所获取的信息及履行的尽职调查,所披露的信息真实、准确、完整,不存在虚假记载、误导性陈述或者重大遗漏;
4、本独立财务顾问有关本次交易的相关事项的专业意见已经提交本独立财务顾问内核机构审查,内核机构同意出具相关意见;
5、本独立财务顾问在与上市公司接触后至担任独立财务顾问期间,已采取严格的保密措施,严格执行风险控制和内部隔离制度,不存在内幕交易,操纵市场和证券欺诈问题。
2-2-3
目 录
声明和承诺 ...... 1
一、独立财务顾问声明 ...... 1
二、独立财务顾问承诺 ...... 2
目 录 ...... 3
释 义 ...... 7
第一节 本次交易概况 ...... 10
一、本次交易的背景和目的 ...... 10
二、本次交易具体方案 ...... 12
三、本次交易的性质 ...... 18
四、本次交易对上市公司的影响 ...... 19
五、本次交易已履行与尚需履行的决策和报批程序 ...... 22
第二节 上市公司基本情况 ...... 25
一、基本信息 ...... 25
二、上市公司主要历史沿革 ...... 25
三、上市公司股权结构情况 ...... 27
四、上市公司控股股东及实际控制人情况 ...... 27
五、上市公司最近六十个月控制权变动情况 ...... 29
六、上市公司最近三年重大资产重组情况 ...... 30
七、上市公司最近三年主营业务发展情况 ...... 30
八、上市公司主要财务数据 ...... 30
九、最近三年合法合规情况 ...... 31
第三节 交易对方基本情况 ...... 33
一、自然人交易对方基本情况 ...... 33
二、法人交易对方基本情况 ...... 36
三、其他事项说明 ...... 39
第四节 交易标的基本情况 ...... 41
一、交易标的基本信息 ...... 41
二、交易标的历史沿革 ...... 41
2-2-4三、交易标的股权结构及控制关系 ...... 45
四、交易标的下属公司情况 ...... 46
五、最近三年股权转让、增减资及资产评估或估值情况 ...... 57
六、交易标的主要资产权属、对外担保及主要负债情况 ...... 69
七、标的公司主营业务情况 ...... 86
八、标的公司财务报表的编制基础、合并财务报表范围及变化情况 ....... 146九、报告期经审计的主要财务数据和财务指标情况 ...... 147
十、标的公司报告期内主要会计政策及相关会计处理 ...... 149
十一、拟购买资产为股权的说明 ...... 150
十二、标的公司涉及立项、环保、行业准入、用地、规划、施工建设等有关报批事项 ...... 151
十三、许可他人使用自己所有的资产或者作为被许可使用他人资产的情况151十四、拟购买资产涉及的债权、债务转移 ...... 151
第五节 交易标的评估情况 ...... 152
一、交易标的评估情况 ...... 152
二、董事会对本次交易评估事项的意见 ...... 194
三、独立董事对本次交易评估事项的意见 ...... 201
四、基于行业政策的评估影响及模拟测算 ...... 202
五、本次评估预测对疫情因素的考量 ...... 231
第六节 发行股份情况 ...... 246
一、发行股份的种类和面值 ...... 246
二、发行对象及发行方式 ...... 246
三、发行价格及定价原则 ...... 246
四、发行数量 ...... 247
五、锁定期安排 ...... 247
六、发行价格调整机制 ...... 248
七、上市地点 ...... 248
第七节 本次交易合同主要内容 ...... 249
一、发行股份及支付现金购买资产协议 ...... 249
二、发行股份及支付现金购买资产协议之补充协议 ...... 255
2-2-5三、发行股份及支付现金购买资产协议之补充协议(二) ...... 257
四、业绩补偿协议 ...... 260
五、业绩补偿协议之补充协议 ...... 262
六、业绩补偿协议之补充协议(二) ...... 265
第八节 独立财务顾问核查意见 ...... 267
一、基本假设 ...... 267
二、上市公司董事会编制的重组报告书符合《重组管理办法》《若干问题的规定》及《格式准则26号》的要求 ...... 267
三、关于交易对方已根据《若干问题的规定》第一条的要求出具了书面承诺和声明,该等承诺和声明已明确记载于重组报告书中 ...... 268
四、上市公司已就本次交易与交易对方签订附条件生效的交易合同;交易合同的生效条件符合《若干问题的规定》第二条的要求,交易合同主要条款齐备,交易合同附带的保留条款、补充协议和前置条件不会对本次交易进展构成实质性影响 ...... 268
五、关于上市公司董事会已按照《若干问题的规定》第四条的要求对相关事项作出明确判断并记载于董事会决议记录中 ...... 270
六、本次交易合规性分析 ...... 271
七、对本次交易所涉及的资产定价公平合理性的核查 ...... 278
八、本次交易根据资产评估结果定价,对所选取的评估方法的适当性、评估假设前提的合理性、重要评估参数取值的合理性发表明确意见 ...... 281
九、结合上市公司管理层讨论与分析,分析说明本次交易完成后上市公司的盈利能力和财务状况、本次交易是否有利于上市公司的持续发展、是否存在损害股东合法权益的问题 ...... 283
十、对交易完成后上市公司的市场地位、经营业绩、持续发展能力、公司治理机制进行全面分析 ...... 285
十一、对交易合同约定的资产支付安排是否可能导致上市公司支付现金或其他资产后不能及时获得对价的风险、相关的违约责任是否切实有效,发表明确意见 ...... 286
十二、本次交易是否构成关联交易的核查 ...... 288
十三、交易对方与上市公司根据《重组管理办法》第三十五条的规定,就
2-2-6
相关资产实际盈利数不足利润预测数的情况签订补偿协议的,独立财务顾问应当对补偿安排的可行性、合理性发表意见 ...... 288
十四、关于本次交易摊薄即期回报情况及填补措施的核查 ...... 292
十五、本次交易符合《重组管理办法》第三条有关拟购买资产存在资金占用问题的适用意见——证券期货法律适用意见第10号 ...... 296
十六、关于相关主体是否存在有偿聘请第三方行为的核查 ...... 296
第九节 独立财务顾问内核程序及内部审核意见 ...... 297
一、独立财务顾问内核程序 ...... 297
二、独立财务顾问内核意见 ...... 297
第十节 独立财务顾问结论意见 ...... 299
2-2-7
释 义
在本报告书中,除非文义载明,以下简称具有如下含义:
| 公司/上市公司/奥赛康 | 指 | 北京奥赛康药业股份有限公司,在深圳证券交易所上市,股票简称:奥赛康,股票代码:002755 |
| 本独立财务顾问/华泰联合证券 | 指 | 华泰联合证券有限责任公司 |
| 南京奥赛康 | 指 | 南京奥赛康投资管理有限公司 |
| 交易对方 | 指 | 庄小金、缪东林、常州倍瑞诗企业管理有限公司、常州伊斯源企业管理有限公司 |
| 唯德康医疗/标的公司/交易标的 | 指 | 江苏唯德康医疗科技有限公司 |
| 倍瑞诗 | 指 | 常州倍瑞诗企业管理有限公司,系唯德康医疗的股东 |
| 伊斯源 | 指 | 常州伊斯源企业管理有限公司,系唯德康医疗的股东 |
| 常州梓瀞 | 指 | 常州梓瀞创业投资合伙企业(有限合伙),系唯德康医疗的股东、员工持股平台 |
| 常州梓熙 | 指 | 常州梓熙创业投资合伙企业(有限合伙),系唯德康医疗的股东、员工持股平台 |
| 久虹医疗 | 指 | 常州市久虹医疗器械有限公司,系唯德康医疗的子公司,于2021年3月由唯德康医疗现金收购而来 |
| 依漫生物 | 指 | 常州市依漫生物科技有限公司,曾系久虹医疗控股子公司,于2021年3月转让 |
| 锦福瑞医疗 | 指 | 常州锦福瑞医疗器械有限公司,系唯德康医疗的子公司 |
| 图云医疗 | 指 | 江苏图云医疗科技有限公司,系唯德康医疗的控股子公司 |
| 东方新星 | 指 | 北京东方新星石化工程股份有限公司 |
| 新星有限 | 指 | 保定新星石化工程有限责任公司 |
| 标的资产 | 指 | 交易对方持有的标的公司60%股权 |
| 本次重组/本次交易 | 指 | 上市公司拟以发行股份及支付现金方式购买庄小金、缪东林、倍瑞诗和伊斯源合计持有的唯德康医疗60%股权,其中以发行股份方式受让前述交易对方持有的唯德康医疗30%的股权,以支付现金的方式受让前述交易对方持有的唯德康医疗30%的股权 |
| 独立财务顾问报告/本报告书 | 指 |
| 重组报告书 | 指 | 《北京奥赛康药业股份有限公司发行股份及支付现金购买资产报告书(草案)(二次修订稿)》 |
| 《审计报告》 | 指 | 立信会计师事务所(特殊普通合伙)出具的关于本次交易的标的资产审计报告(信会师报字[2021]第ZA15640号) |
| 《备考审阅报告》 | 指 | 立信会计师事务所(特殊普通合伙)出具的关于本次交易的上市公司备考审阅报告(信会师报字[2021]第ZA15637号) |
| 《评估报告》 | 指 | 上海东洲资产评估有限公司出具的关于本次交易的标的资产评估报告(东洲评报字【2021】第0759号) |
2-2-8
| 过渡期 | 指 | 自审计/评估基准日(不含当日)起至标的公司股权转让至上市公司的交割日(含当日)止的期间 |
| 调整净利润 | 指 | 唯德康医疗合并报表中经审计扣除非经常性损益后归属于母公司股东的净利润,加上计入经常性损益的当期股份支付费用后的数额 |
| 立信会计师/审计机构 | 指 | 立信会计师事务所(特殊普通合伙) |
| 东洲评估/评估机构/评估师 | 指 | 上海东洲资产评估有限公司 |
| 国浩律师/律师事务所/法律顾问 | 指 | 国浩律师(南京)事务所 |
| ESD | 指 | 内镜黏膜下剥离术(Endoscopic Submucosal Dissection),该类手术主要用于切除消化道病变组织 |
| ERCP | 指 | 经内镜逆行性胰胆管造影术(Endoscopic Retrograde Cholangiopancreatography),该类手术主要用于治疗胰胆疾病 |
| 欧盟CE | 指 | 欧盟对产品的认证,通过认证的商品可加贴CE(Conformite Europeenne)标识,是产品进入欧盟市场的通行证 |
| 韩国KGMP | 指 | 韩国生产质量管理规范(The Good Manufacturing Practice For Pharmaceutical Products in Korea),是产品进入韩国市场的通行证 |
| MDSAP | 指 | 医疗器械单一审核程序(Medical Device Single Audit Program),是由国际医疗器械监管机构论坛(IMDRF)的成员共同发起,被美国、澳大利亚、巴西、加拿大、日本五国的监管机构共同认可的审核程序 |
| ISO13485 | 指 | 国际标准化组织(ISO)发布的《医疗器械质量管理体系用于法规的要求》国际标准,该标准是专门用于医疗器械产业的一个独立的质量管理体系标准 |
| PMC | 指 | 生产及物料控制(Production Material Control)的缩写,指对生产计划与生产进度的控制,以及对物料的计划、跟踪、收发、存储、使用等各方面的监督与管理和呆滞料的预防处理工作 |
| 《公司章程》 | 指 | 《北京奥赛康药业股份有限公司章程》 |
| 《公司法》 | 指 | 《中华人民共和国公司法》 |
| 《证券法》 | 指 | 《中华人民共和国证券法》 |
| 《重组管理办法》 | 指 | 《上市公司重大资产重组管理办法》 |
| 《发行管理办法》 | 指 | 《上市公司证券发行管理办法》 |
| 《上市规则》 | 指 | 《深圳证券交易所股票上市规则》 |
| 《若干问题的规定》 | 指 | 《关于规范上市公司重大资产重组若干问题的规定》 |
| 《格式准则26号》 | 指 | 公开发行证券的公司信息披露内容与格式准则第26号——上市公司重大资产重组(2018年修订) |
| 中国证监会 | 指 | 中国证券监督管理委员会 |
| 发改委 | 指 | 中华人民共和国国家发展和改革委员会 |
| 卫健委/卫计委 | 指 | 中华人民共和国国家卫生健康委员会,承接了原国家卫生部、国家卫计委职能 |
2-2-9
| 深交所 | 指 | 深圳证券交易所 |
| 最近两年一期/报告期 | 指 | 2019年度、2020年度及2021年1-6月 |
| 元、万元、亿元 | 指 | 人民币元、人民币万元、人民币亿元 |
除另有说明,本报告书中任何表格若出现总计数与所列数值总和不符,均为四舍五入所致。
2-2-10
第一节 本次交易概况
一、本次交易的背景和目的
(一)本次交易背景
1、内镜微创诊疗器械需求持续增长,市场空间巨大
随着人口规模的持续增长和老龄化趋势的加快,全球医疗服务需求不断提升,其中医疗器械市场需求保持强劲势头,是发展最快的行业之一。同时,受益于微创治疗手段的逐步普及,内镜微创诊疗器械作为临床诊疗的重要器械,临床需求日益增长。根据波士顿科学的统计和预测数据,2018年全球内镜微创诊疗器械市场规模为52.2亿美元,其中应用于胆胰管疾病、消化道癌症和消化道出血治疗的器械分别为14亿美元、12亿美元和6亿美元,合计达32亿美元。2022年前述领域器械的市场容量预计达到46亿美元,市场空间巨大。
2、我国消化道系统疾病及癌症高发,消化内镜检查的早筛早治前景光明
在消化道癌症发病率上,我国消化道癌的发病形势较为严峻。根据中华医学会2018年公布的数据,我国新发胃癌、食管癌和结直肠癌的病例占我国全部新发恶性肿瘤病例的13.06%、9.30%和8.89%,发病率排在第二、第三位和第五位。其中,由于我国特有的饮食习惯等问题,我国上消化道(包括胃和食管)癌症发病率显著高于世界平均水平。为提高癌症生存率和生存质量、实现国家癌症防治目标,消化内镜检查的早筛早治至关重要,是目前公认对消化道癌症最有效的检查方法。目前我国内镜检查比例较低,消化内镜的早筛早治需求预计会持续增长。
3、国家战略鼓励行业发展,营造良好发展环境
2019年9月,国家卫健委等十部委联合印发《健康中国行动——癌症防治实施方案(2019-2022年)》,明确提出“到2022年,癌症防治体系进一步完善,危险因素综合防控取得阶段性进展,癌症筛查、早诊早治和规范诊疗水平显著提升,癌症发病率、死亡率上升趋势得到遏制,总体癌症5年生存率比2015年提高3个百分点”。为积极响应国家战略,有效推动癌症由中晚期治疗向早
2-2-11
期筛查转变,内镜微创诊疗器械行业必将迎来良好的发展环境。同时,伴随民众“早筛早治”意识的不断提高、内镜诊疗资源在各层级医疗机构中的不断渗透,内镜微创诊疗器械行业将进入高速发展阶段。
(二)本次交易目的
1、新增医疗器械领域布局,促进产品结构优化升级
上市公司始终围绕总体战略发展目标,聚焦于消化性溃疡、肿瘤、耐药菌感染、慢性病四大领域,不断提高经营水平和竞争能力。通过本次收购标的公司股权,上市公司新增医疗器械领域布局,在不断巩固现有消化领域的优势地位以外,积极进行医疗器械领域的多元化业务拓展,从而促进上市公司在消化领域的产品结构优化升级。本次交易符合上市公司的发展战略,能够进一步增强上市公司的竞争力,有效提升和稳固市场地位。
2、充分发挥协同效应,持续提升盈利能力与增强综合竞争力
上市公司专注于抗消化道溃疡、抗肿瘤、抗耐药菌感染、慢性病等领域的产品研发、生产、销售,在中国医药细分市场具有较高的品牌影响力,目前在中国抗消化性溃疡质子泵抑制剂注射剂产品的细分领域市场占有率第一,是该细分领域的龙头企业。经过二十多年的精耕细作,公司已经形成多品类多层次的产品管线和良好的产品质量口碑。标的公司系一家专注于内镜诊疗器械研发、生产与销售的高新技术企业,旗下拥有“久虹”及“唯德康”两个品牌系列产品,在内镜诊疗器械行业具有较高的市场知名度与品牌影响力。本次交易完成后,公司将注入医疗器械优质资产,公司将利用自身在药物领域优势,推动整合并共享相关优质医疗资源,充分发挥协同效应,持续提升盈利能力与增强综合竞争力。
(三)本次交易剩余40%股权的安排
1、未收购标的资产剩余40%股权的原因
上市公司于本次交易中拟收购唯德康医疗60%股权,剩余40%股权系由唯德康医疗创始股东及核心经营管理团队持有,剩余股东对标的资产的经营决策等方面无特殊影响。
2-2-12
本次交易未收购标的资产剩余40%股权的原因系现阶段保留标的公司管理层的部分股权,有利于保持标的公司经营的持续性和核心团队的稳定性,有利于管理层和核心技术人员在经营管理上保持积极性,进一步保证标的公司完成未来业绩承诺。
2、剩余40%股权的后续计划及安排
关于标的公司剩余40%的股权,上市公司目前尚无明确收购计划,其剩余股权的后续收购计划与安排需视标的公司未来经营情况、行业整体发展情况及标的公司完成业绩承诺等前提条件后,由交易双方再行协商确定。
若后续对本次交易后的剩余股权有进一步的收购计划或者其他资本运作安排,上市公司将会依照相关法律法规的规定以及上市公司规范运作的要求,履行相应的内外部决策审批程序与信息披露义务。
二、本次交易具体方案
本次交易方案为上市公司拟以发行股份及支付现金的方式购买庄小金、缪东林、倍瑞诗和伊斯源持有的唯德康医疗60%股权,其中30%股权由上市公司以现金作为对价支付,其余30%股权由上市公司以向特定对象发行的股份作为对价支付。以2021年3月31日作为基准日,标的公司100%股权的评估值为139,100.00万元,对应标的公司60%股权评估值为83,460.00万元,经友好协商,双方确定本次交易作价为83,400.00万元,本次交易不涉及募集配套资金,主要情况如下:
| 序号 | 名称/姓名 | 拟出让的标的公司股权比例 | 支付对价 (万元) | 发行股份购买部分对应的股权比例 | 以发行股份方式支付金 额(万元) | 现金购买部分对应的股权比例 | 以现金支付金额(万元) |
| 1 | 庄小金 | 35.40% | 49,208.54 | 12.90% | 17,933.54 | 22.50% | 31,275.00 |
| 2 | 缪东林 | 10.17% | 14,139.37 | 2.67% | 3,714.37 | 7.50% | 10,425.00 |
| 3 | 倍瑞诗 | 9.60% | 13,341.46 | 9.60% | 13,341.46 | - | - |
| 4 | 伊斯源 | 4.83% | 6,710.63 | 4.83% | 6,710.63 | - | - |
| 合计 | 60.00% | 83,400.00 | 30.00% | 41,700.00 | 30.00% | 41,700.00 | |
2-2-13
(一)发行股份购买资产
上市公司拟以发行股份方式购买庄小金、缪东林、倍瑞诗和伊斯源合计持有的唯德康医疗30%股权。以2021年3月31日作为基准日,该30%股权的交易作价为41,700.00万元。
1、发行股份的种类和面值
本次交易中拟发行的股份种类为人民币普通股(A股),每股面值为人民币1.00元,上市地点为深交所。
2、发行对象及发行方式
本次拟发行股份购买资产的发行方式为向特定对象发行,发行对象为庄小金、缪东林、倍瑞诗和伊斯源。
3、发行价格及定价原则
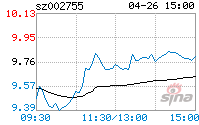
根据《重组管理办法》的相关规定,上市公司发行股份的价格不得低于市场参考价的90%。市场参考价为本次交易的董事会决议公告日前20个交易日、60个交易日或者120个交易日的公司股票交易均价之一。
本次发行股份购买资产涉及的定价基准日为上市公司本次发行股份及支付现金购买资产的首次董事会决议公告日,即2021年4月26日。经计算,上市公司本次发行股份购买资产可选择的市场参考价为:
| 董事会决议公告日 | 前20个交易日 | 前60个交易日 | 前120个交易日 |
| 市场参考价(元/股) | 14.59 | 14.02 | 14.51 |
| 市场参考价的90%(元/股) | 13.13 | 12.62 | 13.06 |
交易均价的计算公式为:董事会决议公告日前若干个交易日公司股票交易均价=决议公告日前若干个交易日公司股票交易总额/决议公告日前若干个交易日公司股票交易总量。
经交易各方协商一致,本次发行股份购买资产的股份发行价格为于定价基准日前20个交易日公司股票交易均价,为14.59元/股。因上市公司实施2020年年度权益分派方案事项,本次股份发行价格调整为14.39元/股,本次发行价
2-2-14
格已经上市公司2021年第一次临时股东大会审议确定。在定价基准日至发行日期间,如上市公司出现派息、送股、资本公积金转增股本等除权除息事项,上市公司将按照深交所相关规则对本次发行价格和发行数量作相应调整,最终发行股数以中国证监会最终核准的股数为准。发行价格的具体调整方法如下:
假设调整前发行价格为P0,每股送股或转增股本数为N,每股配股数为K,配股价为A,每股派息为D,调整后发行价格为P1(调整值保留小数点后两位,最后一位实行四舍五入),则:
派息:P1=P0-D
送股或转增股本:P1=P0/(1+N)
配股:P1=(P0+AK)/(1+K)
假设以上三项同时进行:P1=(P0-D+AK)/(1+K+N)
4、发行数量
按照以发行股份方式购买的标的公司的30%股权的交易对价41,700.00万元以及14.39元/股的发行价格测算,本次交易拟发行股份购买资产的发行数量为28,978,455股,不足一股的部分由交易对方无偿赠予上市公司。最终发行数量以中国证监会核准的发行数量为准。具体发行股数如下:
| 序号 | 名称/姓名 | 发行数量(股) |
| 1 | 庄小金 | 12,462,501 |
| 2 | 缪东林 | 2,581,218 |
| 3 | 倍瑞诗 | 9,271,341 |
| 4 | 伊斯源 | 4,663,395 |
| 合计 | 28,978,455 | |
在发行股份购买资产的定价基准日至发行日期间,如上市公司实施现金分红、送红股及资本公积金转增股本等除权、除息事项,则将根据中国证监会及深交所的相关规定对发行数量作相应调整。
2-2-15
5、锁定期安排
本次发行股份购买资产的交易对方对其在本次交易中获得的上市公司股份锁定期安排如下:
庄小金、缪东林因本次发行股份购买资产而获得上市公司的股份(包括在股份锁定期内因上市公司分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起36个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。
倍瑞诗、伊斯源因本次发行股份购买资产而获得上市公司的股份(包括在股份锁定期内因上市公司分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起12个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。
若上述锁定股份的承诺与证券监管部门的最新监管意见不符的,将按照《证券法》等相关法律法规的规定及相关证券监管部门的最新监管意见锁定。
业绩承诺期内,如前述锁定期届满后,交易对方持有的上市公司向其定向增发的前述股份将继续锁定并按业绩承诺期内各年度业绩累计完成情况分批解锁,各期可解锁股份数量如下:当期可解锁股份数量=上市公司向交易对方定向发行股份数量*截至当期期末累计实现的调整净利润/交易对方于业绩承诺期内承诺的调整净利润总额-累计已经解锁股份,在业绩承诺期结束后,如未达到合计承诺调整净利润但交易对方已经履行完毕全部补偿义务后解锁所有股份。
本次发行完成后,由于上市公司送红股、转增股本等原因而孳息的上市公司股份,亦遵照上述锁定期进行锁定。锁定期届满之后股份的交易按照中国证监会及深交所的有关规定执行。
交易对方因本次交易而获得的股份在锁定期届满后减持还需遵守届时应遵守的法律、深交所相关规则以及上市公司《公司章程》的规定。
6、发行价格调整机制
本次发行股份购买资产的发行价格不设置调整机制。
2-2-16
(二)支付现金购买资产
上市公司拟以支付现金的方式购买庄小金及缪东林持有的唯德康医疗30%的股权。以2021年3月31日作为基准日,该等30%股权的交易作价为41,700.00万元,具体交易情况如下:
| 序号 | 姓名 | 支付现金(万元) |
| 1 | 庄小金 | 31,275.00 |
| 2 | 缪东林 | 10,425.00 |
| 合计 | 41,700.00 | |
(三)上市公司支付保证金和定金的具体安排及原因
根据交易双方于2021年4月23日签署的附生效条件的《发行股份及支付现金购买资产协议》,在该协议签署后2日内,上市公司向庄小金、缪东林指定账户支付人民币1,000.00万元的保证金;在上市公司召开股东大会后十个工作日内,上市公司向庄小金、缪东林指定账户支付现金人民币8,000.00万元作为定金。因此保证金及定金合计金额为9,000.00万元。
上述保证金及定金将于本次交易取得中国证监会核准当日自动转为第一期现金支付款。
若本次交易未获中国证监会核准,且未被核准的原因系因交易对方违约导致的标的公司发生重大不利变化,交易对方应于3个月内返还定金及保证金;若本次交易未获中国证监会核准,且未被核准的原因并非为交易对方违约导致的标的公司发生重大不利变化时,上市公司将于收到未获核准通知后3个月内与交易对方协商并签署完成新的购买资产协议,交易对方不返还上市公司已支付的定金、保证金,上市公司已支付的定金、保证金将自动转为新的购买资产协议项下的标的资产交易对价支付款的一部分。若交易双方未能在新的购买资产协议签订后24个月之内完成收购,则交易对方将于前述24个月期满后30日内向上市公司全额返还定金和保证金。
上市公司支付保证金和定金的原因主要为提前锁定优质资产,确保本次交易的顺利推进,具体如下:
2-2-17
1、标的资产盈利能力方面
唯德康医疗深耕消化诊疗器械领域多年,具备较为稳定的盈利能力。报告期内,标的公司持续保持良好增长态势,经营规模不断扩大,营业收入不断上升。2019年度、2020年度和2021年1-6月,剔除口罩业务后标的公司营业收入分别为27,008.99万元、31,321.90万元和21,822.40万元,实现净利润6,165.03万元、8,883.72万元和1,555.84万元(扣除因非同比例增资导致一次性确认的计入非经常性损益的股份支付费用后,净利润为5,172.50万元)。
2、标的资产行业地位及市场占有率情况
唯德康医疗旗下拥有“久虹”和“唯德康”两个品牌系列产品,围绕消化内镜诊疗领域进行了系统性的产品布局,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求,具备较强的市场竞争力。凭借丰富的产品管线、优质的产品质量及优秀的临床使用效果,标的公司已经在行业内树立了较高的市场知名度和品牌影响力。
参考国内上市公司和拟上市公司披露的财务数据
和行业情况,国内企业中,南微医学2019年市占率约为18%、标的公司约为4%、安杰思约为3%。标的公司市场占有率处于国内企业前列,具备较强的行业竞争优势。
3、与上市公司的协同性方面
标的公司作为消化内镜诊疗领域的优秀企业之一,具有较强的市场竞争力。本次收购将有助于上市公司进一步丰富产品管线,在消化道诊疗领域的布局将更加完善和多元化,初步形成“药物+器械”的产业链布局。本次收购使得上市公司能够积极利用自身在药物领域的优势,结合标的公司在医疗器械领域的经验积累,围绕消化领域进行相关优质医疗资源的整合,充分发挥与标的公司的协同效应,实现共赢。
4、交易紧迫性方面
交易双方就本次交易协商过程中均表现出了极大的诚意,双方在《合作意
数据来源:《南京微创医学科技股份有限公司首次公开发行股票并在科创板上市招股说明书》、《杭州安杰思医学科技股份有限公司首次公开发行股票并在科创板上市招股说明书》
2-2-18
向书》中约定了2个月的排他期,即自合作意向书生效之日起2个月内,除另有约定外,交易对方及标的公司不得与第三方商谈或进行类似的合作,排他期届满后交易对方及标的公司即可与其他第三方接洽合作。为推进本次交易顺利实施,增加交易的确定性,标的资产方面于本次交易前对唯德康医疗及久虹医疗进行内部重组,实现有效整合,从而简化与上市公司重组交易安排;上市公司方面本着公平公正的商业履约精神,协商支付一定比例的保证金及定金增加本次交易的确定性。基于上述考虑,上市公司支付保证金和定金有利于提前锁定优质资产,确保本次交易的顺利推进,有利于保护上市公司和中小股东权益。
三、本次交易的性质
(一)本次交易不构成重大资产重组
本次交易中,上市公司拟收购标的公司60%的股权。根据标的公司最近一年经审计的资产总额、资产净额及营业收入以及本次交易金额情况,并与上市公司最近一个会计年度经审计的财务数据进行比较,本次交易未达到《重组管理办法》规定的重大资产重组标准,不构成上市公司重大资产重组。具体情况如下:
单位:万元
| 比较项目 | 上市公司 | 标的公司 | 交易金额 | 计算依据 | 指标占比 |
| 资产总额 | 380,809.94 | 30,351.21 | 83,400.00 | 83,400.00 | 21.90% |
| 归属于母公司所有者资产净额 | 302,715.13 | 8,381.57 | 83,400.00 | 83,400.00 | 27.55% |
| 营业收入 | 378,268.89 | 37,412.50 | - | 37,412.50 | 9.89% |
注:标的公司和上市公司的财务数据为截至2020年末的资产总额、归属于母公司所有者资产净额及2020年度所产生的营业收入
本次交易涉及发行股份购买资产,因此需提交并购重组委审核,并经中国证监会核准后方可实施。
(二)本次交易不构成重组上市
根据《重组管理办法》第十三条,构成重组上市指:上市公司自控制权发生变更之日起36个月内,向收购人及其关联人购买资产,导致上市公司发生以
2-2-19
下根本变化情形之一的,构成重大资产重组:
(一)购买的资产总额占上市公司控制权发生变更的前一个会计年度经审计的合并财务会计报告期末资产总额的比例达到100%以上;
(二)购买的资产在最近一个会计年度所产生的营业收入占上市公司控制权发生变更的前一个会计年度经审计的合并财务会计报告营业收入的比例达到100%以上;
(三)购买的资产净额占上市公司控制权发生变更的前一个会计年度经审计的合并财务会计报告期末净资产额的比例达到100%以上;
(四)为购买资产发行的股份占上市公司首次向收购人及其关联人购买资产的董事会决议前一个交易日的股份的比例达到100%以上;
(五)上市公司向收购人及其关联人购买资产虽未达到本款第(一)至第
(四)项标准,但可能导致上市公司主营业务发生根本变化;
(六)中国证监会认定的可能导致上市公司发生根本变化的其他情形。
本次交易后,预计南京奥赛康仍为上市公司的控股股东、陈庆财仍为上市公司的实际控制人。因此,本次交易未达到《重组管理办法》第十三条规定的重组上市标准,本次交易不构成重组上市。
(三)本次交易不构成关联交易
本次交易前,本次发行股份及支付现金购买资产的交易对方与上市公司之间不存在关联关系;本次交易完成后,预计各交易对方持有上市公司股份低于5%。因此,本次交易不构成关联交易。
四、本次交易对上市公司的影响
(一)本次交易对上市公司股权结构的影响
截至本报告书签署日,上市公司总股本为928,160,351股,控股股东南京奥赛康直接持有上市公司34.20%的股权,陈庆财及其一致行动人合计控制奥赛康
46.42%股份。
2-2-20
本次交易中,上市公司拟以发行股份购买标的资产的交易作价合计41,700.00万元,对应发行股份数量合计28,978,455股。本次交易完成后,上市公司总股本将增加至957,138,806股,上市公司控股股东仍为南京奥赛康,持股比例为33.17%,实际控制人仍为陈庆财,陈庆财及其一致行动人合计控制奥赛康45.01%股份。
本次交易完成前后,上市公司的股权结构如下:
| 序号 | 股东名称 | 本次交易前 | 本次交易后 | ||
| 持股数量(股) | 持股比例(%) | 持股数量(股) | 持股比例(%) | ||
| 1 | 南京奥赛康投资管理有限公司 | 317,470,588 | 34.20 | 317,470,588 | 33.17 |
| 2 | 中亿伟业控股有限公司 | 143,617,647 | 15.47 | 143,617,647 | 15.00 |
| 3 | 江苏苏洋投资实业有限公司 | 143,617,647 | 15.47 | 143,617,647 | 15.00 |
| 4 | 伟瑞发展有限公司 | 113,382,352 | 12.22 | 113,382,352 | 11.85 |
| 5 | 南京海济投资管理有限公司 | 37,794,117 | 4.07 | 37,794,117 | 3.95 |
| 6 | 本次交易前其他 股东 | 172,278,000 | 18.56 | 172,278,000 | 18.00 |
| 7 | 庄小金 | - | - | 12,462,501 | 1.30 |
| 8 | 缪东林 | - | - | 2,581,218 | 0.27 |
| 9 | 倍瑞诗 | - | - | 9,271,341 | 0.97 |
| 10 | 伊斯源 | - | - | 4,663,395 | 0.49 |
| 合计 | 928,160,351 | 100.00 | 957,138,806 | 100.00 | |
(二)本次交易对上市公司业务的影响
本次上市公司拟收购从事内镜诊疗器械的研发、生产和销售的唯德康医疗60%股权。标的公司是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业。标的公司拥有“久虹”和“唯德康”两个品牌系列产品,围绕内镜诊疗领域进行了系统性的产品布局,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求,具备较强的市场竞争力。销售渠道方面,标的公司通过优质的产品服务与经销商及终端客户建立了较为牢固的联系,国内营销网络已经基本覆盖全国各个重点城市,相关产品已销往德国、法国、日本、韩国、英国等多个国家和地区。
2-2-21
上市公司专注于抗消化道溃疡、抗肿瘤、抗耐药菌感染、慢性病等领域的产品研发、生产、销售。其中,消化道领域产品为公司最主要的收入来源,公司在中国抗消化性溃疡质子泵抑制剂注射剂产品的细分领域市场占有率第一,是该细分领域的龙头企业。通过对标的资产的收购,上市公司在消化道诊疗领域的布局将更加完善和多元化,在细分领域内的影响力将得到进一步增加。同时,本次收购有助于上市公司和标的公司进一步丰富产品管线,拓展销售渠道,加速产品商业化进程。
(三)本次交易对上市公司财务状况和盈利能力的影响
本次交易完成后,上市公司将进入内镜诊疗器械领域,进一步拓宽了公司在消化道诊疗领域的业务布局,创造新的收入增长点,使上市公司综合竞争实力和持续经营能力得到进一步增强,符合公司及全体股东的利益。
根据上市公司未经审计的2021年1-6月财务报表、经审计的2020年财务报表以及经审阅的备考财务报表,上市公司最近一年一期主要财务数据比较如下:
单位:万元
| 项目 | 2021年6月30日/ 2021年1-6月 | 2020年12月31日/ 2020年度 | ||
| 未审数 | 备考数 | 审定数 | 备考数 | |
| 总资产 | 355,879.79 | 462,670.16 | 380,809.94 | 486,570.24 |
| 归属于上市公司股东的所有者权益 | 310,400.48 | 351,986.45 | 302,715.13 | 336,032.85 |
| 归属于上市公司股东的每股净资产(元/股) | 3.34 | 3.68 | 3.26 | 3.51 |
| 营业收入 | 167,404.96 | 189,231.11 | 378,268.89 | 415,681.39 |
| 归属于上市公司股东的净利润 | 26,316.94 | 26,679.22 | 72,162.51 | 75,835.31 |
| 基本每股收益 (元/股) | 0.28 | 0.28 | 0.78 | 0.79 |
| 基本每股收益(扣非后)(元/股) | 0.27 | 0.29 | 0.72 | 0.74 |
本次交易前,上市公司2020年度基本每股收益为0.78元/股,本次交易完成后,上市公司2020年备考基本每股收益为0.79元/股,每股收益得到增厚,本次交易进一步提升了上市公司的盈利能力。
2-2-22
本次交易前,上市公司2021年1-6月基本每股收益为0.28元/股,基本每股收益(扣非后)为0.27元/股;本次交易完成后,上市公司2021年1-6月备考基本每股收益为0.28元/股,备考基本每股收益(扣非后)为0.29元/股,从基本每股收益来看,除去四舍五入的因素,本次交易前,上市公司2021年1-6月基本每股收益为0.2835元/股,本次交易后,上市公司2021年1-6月备考基本每股收益为0.2787元/股,短期内上市公司2021年1-6月基本每股收益被摊薄,主要原因系标的公司于2021年3月内部重组时因非同比例增资导致一次性确认了3,616.67万元计入非经常性损益的股份支付费用,扣除该等非经常性损益因素后,备考基本每股收益(扣非后)有所上升,本次交易总体上有利于增强上市公司的盈利能力。
五、本次交易已履行与尚需履行的决策和报批程序
(一)本次交易已履行的决策和报批程序
1、上市公司已履行的决策和报批程序
2021年4月23日,上市公司召开第五届董事会第九次会议,审议通过了《关于本次发行股份及支付现金购买资产交易方案的议案》等相关议案,上市公司独立董事发表了独立意见。
2021年7月13日,上市公司召开第五届董事会第十一次会议,审议通过了《关于本次发行股份及支付现金购买资产交易方案的议案》等相关议案,上市公司独立董事发表了独立意见。
2021年7月29日,上市公司召开2021年第一次临时股东大会,审议通过了《关于本次发行股份及支付现金购买资产交易方案的议案》等相关议案。
2021年7月30日,上市公司召开第五届董事会第十二次会议,审议通过《关于签署附生效条件的<业绩补偿协议之补充协议二>的议案》,该议案根据2021年第一次临时股东大会审议通过的《关于提请股东大会授权董事会办理本次交易相关事宜的议案》,无需再提交股东大会审议,上市公司独立董事发表了独立意见。
2021年9月30日,上市公司召开第五届董事会第十四次会议,审议通过《关
2-2-23
于签署附生效条件的<发行股份及支付现金购买资产协议之补充协议(二)>的议案》《关于批准本次资产重组相关的审计报告、审阅报告及财务报表的议案》等议案,该议案根据2021年第一次临时股东大会审议通过的《关于提请股东大会授权董事会办理本次交易相关事宜的议案》,无需再提交股东大会审议,上市公司独立董事发表了独立意见。
2、交易对方已履行的决策和报批程序
2021年4月22日,倍瑞诗召开股东会,同意本次交易事项,并授权公司执行董事代表公司全权协商本次股权转让具体事宜。
2021年4月22日,伊斯源召开股东会,同意本次交易事项,并授权公司执行董事代表公司全权协商本次股权转让具体事宜。
各交易对方已于2021年4月23日分别与上市公司签署了附生效条件的《发行股份及支付现金购买资产协议》及附生效条件的《业绩补偿协议》。
2021年7月13日,倍瑞诗及伊斯源召开股东会,同意本次交易事项。
各交易对方已于2021年7月13日分别与上市公司签署了附生效条件的《发行股份及支付现金购买资产协议之补充协议》及附生效条件的《业绩补偿协议之补充协议》,于2021年7月30日与上市公司签署了附生效条件的《业绩补偿协议之补充协议(二)》,并于2021年9月30日与上市公司签署附生效条件的《发行股份及支付现金购买资产协议之补充协议(二)》。
3、标的公司已履行的决策和报批程序
2021年4月22日,标的公司唯德康医疗作出股东会决议,同意唯德康医疗股东倍瑞诗、伊斯源、庄小金和缪东林将其合计持有唯德康医疗60%的股权转让给上市公司。
2021年7月13日,标的公司唯德康医疗作出股东会决议,同意唯德康医疗股东倍瑞诗、伊斯源、庄小金和缪东林将其合计持有唯德康医疗60%的股权转让给上市公司,其余股东同意放弃优先受让权。
2-2-24
(二)本次交易尚需履行的决策和报批程序
本次交易尚需获得中国证监会的核准,该核准为本次交易的前提条件,本次交易方案的实施以取得上述核准为前提,未取得上述核准前不得实施。
本次交易能否取得上述核准以及取得上述核准的时间存在不确定性,提请广大投资者注意投资风险。
2-2-25
第二节 上市公司基本情况
一、基本信息
| 中文名称 | 北京奥赛康药业股份有限公司 |
| 曾用名 | 北京东方新星石化工程股份有限公司 |
| 英文名称 | Beijing Aosaikang Pharmaceutical Co., Ltd. |
| 股票简称 | 奥赛康 |
| 股票代码 | 002755 |
| 成立时间 | 1996年12月24日 |
| 上市日期 | 2015年5月15日 |
| 上市地 | 深圳证券交易所 |
| 注册资本 | 92,816.0351万元人民币 |
| 公司类型 | 股份有限公司(台港澳与境内合资、上市) |
| 统一社会信用代码 | 91110000108283057Y |
| 法定代表人 | 陈庆财 |
| 注册地址 | 北京市丰台区南四环西路188号七区28号楼 |
| 办公地址 | 江苏省南京江宁科学园科建路699号 |
| 办公地址邮政编码 | 211112 |
| 电话 | 025-52292222 |
| 传真 | 025-52169333 |
| 公司网站 | www.ask-pharm.com |
| 电子信箱 | ir@ask-pharm.com |
| 经营范围 | 医学研究与试验发展;技术咨询、技术服务;货物进出口、技术进出口;企业管理;销售化工产品。(企业依法自主选择经营项目,开展经营活动;销售化工产品以及依法须经批准的项目,经相关部门批准后依批准的内容开展经营活动;不得从事本市产业政策禁止和限制类项目的经营活动。) |
二、上市公司主要历史沿革
(一)2007年12月,整体变更设立股份公司
奥赛康原名北京东方新星石化工程股份有限公司,2005年8月改制设立保定新星石化工程有限责任公司。2007年12月4日,经新星有限临时股东会审议,同意将新星有限整体变更设立为股份公司。同日,保定新星石化工程股份有限
2-2-26
公司(筹)召开首次股东大会,决议通过新星有限以截至2007年11月30日经审计的账面净资产折股的方式整体变更为股份有限公司;2008年7月,迁入北京市丰台区总部基地,更名为“北京东方新星石化工程股份有限公司”。
(二)2015年4月,首次公开发行股票并上市
2015年4月23日,经中国证监会“证监许可[2015]721号”《关于核准北京东方新星石化工程股份有限公司首次公开发行股票的批复》和深圳证券交易所“深证上[2015]195号”《上市通知书》审核批准,东方新星发行的2,534万股社会公众股票于2015年5月15日在深圳证券交易所挂牌交易。本次发行完成后,东方新星总股本变更为101,340,000股。
(三)2018年12月,重大资产置换及发行股份购买资产暨关联交易
2018年7月9日,东方新星第四届董事会第二次临时会议审议通过了《关于本次重大资产置换及发行股份购买资产的议案》等议案,启动重大资产重组事宜,并于2018年7月10日披露了《北京东方新星石化工程股份有限公司重大资产置换及发行股份购买资产暨关联交易预案》。
2018年8月26日,东方新星召开第四届董事会第八次会议,审议通过了与重大资产重组的重组报告书(草案)相关的议案。
2018年9月12日,东方新星召开2018年第一次临时股东大会,审议通过了与重大资产重组的重组报告书(草案)相关的议案。
2018年12月24日,中国证监会核发证监许可[2018]2148号《关于核准北京东方新星石化工程股份有限公司重大资产重组及向南京奥赛康投资管理有限公司等发行股份购买资产的批复》。
2019年1月9日,东方新星在中国证券登记结算有限责任公司深圳分公司办理了755,882,351股新增股份的登记手续,并于2019年1月22日完成新增股份上市。
(四)2019年3月,更名为北京奥赛康药业股份有限公司
2019年3月4日,东方新星完成工商变更,正式更名为“北京奥赛康药业
2-2-27
股份有限公司”,并于2019年3月11日,经深圳证券交易所核准,变更公司证券简称为“奥赛康”。
三、上市公司股权结构情况
截至2021年6月30日,上市公司前十大股东持股情况如下:
| 序号 | 股东名称 | 持股数量(股) | 持股比例(%) |
| 1 | 南京奥赛康投资管理有限公司 | 317,470,588 | 34.20 |
| 2 | 中亿伟业控股有限公司 | 143,617,647 | 15.47 |
| 3 | 江苏苏洋投资实业有限公司 | 143,617,647 | 15.47 |
| 4 | 伟瑞发展有限公司 | 113,382,352 | 12.22 |
| 5 | 南京海济投资管理有限公司 | 37,794,117 | 4.07 |
| 6 | 陈会利 | 13,852,163 | 1.49 |
| 7 | 曲维孟 | 2,702,300 | 0.29 |
| 8 | 赵小奇 | 2,450,000 | 0.26 |
| 9 | 香港中央结算有限公司 | 2,218,457 | 0.24 |
| 10 | 胡德新 | 1,931,700 | 0.21 |
| 合计 | 779,036,971 | 83.92 | |
四、上市公司控股股东及实际控制人情况
(一)股权控制关系
截至2021年6月30日,上市公司的股权控制关系如下图所示:
2-2-28
(二)控股股东及实际控制人基本情况
1、控股股东基本情况
截至本报告书签署日,南京奥赛康直接持有34.20%的股权,为上市公司的控股股东。南京奥赛康的基本信息如下:
| 企业名称 | 南京奥赛康投资管理有限公司 |
| 曾用名 | 南京奥赛康医药集团有限公司、南京奥赛康医药科技有限公司 |
| 企业类型 | 有限责任公司(自然人投资或控股) |
| 法定代表人 | 陈庆财 |
| 成立日期 | 1996年11月25日 |
| 注册资本 | 3,200万元人民币 |
| 注册地址 | 南京江宁科学园科建路699号 |
| 统一社会信用代码 | 91320115608961387E |
| 经营范围 | 预包装食品批发与零售;实业投资与管理;物业管理;计算机维修;文具用品零售;技术推广服务及相关咨询服务。(依法须经批准的项目,经相关部门批准后方可开展经营活动) |
| 股东情况 | 陈庆财持股54.761%、张君茹持股23.810%、戴建国持股19.048%、陈靖持股2.381% |
2、实际控制人基本情况
截至本报告书签署日,自然人陈庆财持有南京奥赛康54.761%的股权,其配偶张君茹作为一致行动人持有南京奥赛康23.810%的股权,两人合计持有南京奥赛康78.571%的股权,为南京奥赛康的实际控制人。因此,陈庆财可通过南京奥赛康控制上市公司34.20%的股权。此外,陈庆财女儿CHEN HONGYU作为一致行动人通过全资控制的境外公司伟瑞发展持有上市公司113,382,352股股份,占上市公司总股本的12.22%。因此,陈庆财及其一致行动人合计控制奥赛康
46.42%股份,陈庆财为奥赛康的实际控制人。陈庆财先生的基本情况如下:
陈庆财,男,1959年出生,汉族,中国国籍,拥有澳大利亚及新加坡永久居留权,1988年获得上海医科大学(现复旦大学)临床药学硕士学位,1997年获得南京医科大学药理学博士学位,担任南京医科大学和南京工业大学的客座教授;是国家“创新人才推进计划”和“万人计划”人才。陈先生创立了江苏省最早的民营新药研发机构南京海光应用化学研究所,主导研发上市了中国第
2-2-29
一支国产质子泵抑制剂注射剂。陈先生创建的“以健康为本的‘头尾创新’奥赛康管理模式”引领了奥赛康的快速、可持续发展。陈先生主导研发上市了20多个新药,承担过3项国家火炬计划、4项“重大新药创制”国家重大科技专项课题以及多项省市科技计划。先后获得中华全国工商联科技进步一等奖、中国药学会科学技术二等奖以及多个江苏省科学技术奖;荣获南京市人民政府颁发的南京市科技功臣、南京市市长质量奖个人奖,主导江苏奥赛康药业有限公司获得了江苏省质量奖、中国质量奖提名奖等。陈先生现任上市公司董事长、总经理。
五、上市公司最近六十个月控制权变动情况
上市公司系由保定新星石化工程有限责任公司整体变更而来,保定新星石化工程有限责任公司系中国石化集团勘察设计院改制而来,受企业改制政策的限制,上市前其股权结构较为分散。2011年11月20日,为进一步巩固陈会利先生的实际控制地位,陈会利与曲维孟、胡德新等其他23位自然人股东签署了《一致行动协议》(协议自各方签署之日起生效,至东方新星首次公开发行的股票上市交易之日起满36个月后失效),约定在处理有关需经东方新星股东大会审议批准的事项时,各方同意以陈会利的意思表示采取一致行动,作出相同的意思表示。通过前述一致行动安排,陈会利可控制较高比例的公司股份表决权,系公司的控股股东、实际控制人。上述一致行动协议于2018年5月15日到期,此后未延期或签署新的《一致行动协议》,一致行动人关系终止。因此,2018年5月15日至2019年1月期间,东方新星成为无实际控制人公司。
2018年12月24日,中国证监会核发证监许可[2018]2148号《关于核准北京东方新星石化工程股份有限公司重大资产重组及向南京奥赛康投资管理有限公司等发行股份购买资产的批复》。该重大资产重组新增股份于2019年1月正式上市。上市公司由无控股股东变更为由南京奥赛康控股,实际控制人亦由无实控人变更为陈庆财先生。
2-2-30
六、上市公司最近三年重大资产重组情况
2018年7月9日,上市公司第四届董事会第二次临时会议审议通过了《关于本次重大资产置换及发行股份购买资产的议案》等议案,启动重大资产重组事宜,并于2018年7月10日披露了《北京东方新星石化工程股份有限公司重大资产置换及发行股份购买资产暨关联交易预案》。2018年8月26日,上市公司召开第四届董事会第八次会议,审议通过了与重大资产重组的重组报告书(草案)相关的议案。2018年9月12日,上市公司召开2018年第一次临时股东大会,审议通过了与重大资产重组的重组报告书(草案)相关的议案。
2018年12月24日,中国证监会核发证监许可[2018]2148号《关于核准北京东方新星石化工程股份有限公司重大资产重组及向南京奥赛康投资管理有限公司等发行股份购买资产的批复》。新增股份于2019年1月22日上市,前次重大资产重组完成。
七、上市公司最近三年主营业务发展情况
上市公司于2018年12月完成了前次重大资产重组,前次重大资产重组新增股份于2019年1月正式上市。前次重大资产重组前,上市公司主要从事为石油化工行业、新型煤化工行业的大型建设项目提供工程勘察和岩土工程施工服务等业务。重大资产重组实施完成后,上市公司的主营业务变更为药品研发、生产和销售。
八、上市公司主要财务数据
上市公司2018年度、2019年度、2020年度和2021年1-6月的主要财务数据如下:
(一)合并资产负债表主要数据
单位:万元
| 项目 | 2021.6.30 | 2020.12.31 | 2019.12.31 | 2018.12.31 |
| 资产总额 | 355,879.79 | 380,809.94 | 369,209.70 | 295,825.45 |
| 负债总额 | 45,200.64 | 77,489.14 | 117,552.54 | 111,726.83 |
| 归属于母公司股东 | 310,400.48 | 302,715.13 | 251,354.80 | 183,821.83 |
2-2-31
| 项目 | 2021.6.30 | 2020.12.31 | 2019.12.31 | 2018.12.31 |
| 的所有者权益 | ||||
| 所有者权益合计 | 310,679.15 | 303,320.80 | 251,657.17 | 184,098.62 |
(二)合并利润表主要数据
单位:万元
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 | 2018年度 |
| 营业收入 | 167,404.96 | 378,268.89 | 451,863.17 | 393,188.17 |
| 营业利润 | 28,674.12 | 79,030.16 | 87,199.76 | 74,447.90 |
| 利润总额 | 28,872.22 | 82,119.84 | 88,793.32 | 75,493.43 |
| 净利润 | 26,001.57 | 72,536.87 | 77,990.17 | 66,890.37 |
| 归属于母公司所有者的净利润 | 26,316.94 | 72,162.51 | 78,095.92 | 67,007.36 |
(三)合并现金流量表主要数据
单位:万元
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 | 2018年度 |
| 经营活动产生的现金流量净额 | 25,123.73 | 58,038.40 | 53,461.60 | 49,715.88 |
| 投资活动产生的现金流量净额 | -56,068.37 | -21,573.85 | -29,438.26 | -14,177.01 |
| 筹资活动产生的现金流量净额 | -20,561.28 | -18,282.43 | -12,471.69 | -1,545.10 |
| 现金及现金等价物净增加额 | -51,506.71 | 18,175.96 | 11,553.19 | 33,998.26 |
(四)主要财务指标
| 项目 | 2021.6.30/ 2021年1-6月 | 2020.12.31/ 2020年度 | 2019.12.31/ 2019年度 | 2018.12.31/ 2018年度 |
| 资产负债率(合并) | 12.70% | 20.35% | 31.84% | 37.77% |
| 综合毛利率 | 92.25% | 91.77% | 92.56% | 92.94% |
| 基本每股收益(元/股) | 0.28 | 0.78 | 0.84 | 0.89 |
| 加权平均净资产收益率 | 8.58% | 26.03% | 35.94% | 42.58% |
九、最近三年合法合规情况
(一)上市公司及其现任董事、监事、高级管理人员因涉嫌犯罪正被司法机关立案侦查或涉嫌违法违规正被中国证监会立案调查情况的说明截至本报告书签署日,上市公司及其现任董事、监事、高级管理人员不存
2-2-32
在因涉嫌犯罪正被司法机关立案侦查或涉嫌违法违规正被中国证监会立案调查的情况。
(二)上市公司及其控股股东、实际控制人,以及上市公司现任董事、监事、高级管理人员最近12个月内受到证券交易所公开谴责或其他重大失信行为情况的说明最近12个月内,上市公司及其控股股东、实际控制人以及上市公司现任董事、监事、高级管理人员,不存在受到证券交易所公开谴责的情况,也不存在其他重大失信行为的情况。
(三)上市公司及其控股股东、实际控制人,以及上市公司现任董事、监事、高级管理人员最近三年受到行政处罚或刑事处罚情况的说明
最近三年,上市公司及其控股股东、实际控制人以及上市公司现任董事、监事、高级管理人员,不存在受到行政处罚或刑事处罚的情况。
2-2-33
第三节 交易对方基本情况本次发行股份及支付现金购买资产的交易对方系唯德康医疗股东庄小金、缪东林、倍瑞诗和伊斯源。
一、自然人交易对方基本情况
本次发行股份及支付现金购买资产交易包含庄小金和缪东林两名自然人股东,两名自然人股东的基本情况如下:
(一)庄小金
1、基本情况
| 姓名 | 庄小金 |
| 曾用名 | 无 |
| 性别 | 男 |
| 国籍 | 中国 |
| 证件号码 | 32042119751022**** |
| 住所 | 江苏省常州市武进经济开发区**** |
| 通讯地址 | 江苏省常州市武进经济开发区**** |
| 是否取得其他国家或地区的居留权 | 否 |
2、最近三年职业和职务及与任职单位存在的产权关系
庄小金最近三年主要任职情况如下:
| 序号 | 任职单位 | 职务 | 起止时间 | 是否存在持股情况 |
| 1 | 江苏唯德康医疗科技有限公司 | 执行董事兼总经理 | 2012年10月至今 | 是 |
| 2 | 常州市久虹医疗器械有限公司 | 执行董事兼总经理 | 2005年12月至今 | 唯德康医疗子公司 |
| 3 | 常州锦福瑞医疗器械有限公司 | 执行董事 | 2020年8月至今 | 唯德康医疗子公司 |
| 4 | 江苏图云医疗科技有限公司 | 执行董事 | 2021年2月至今 | 唯德康医疗控股公司 |
| 5 | 常州市恒可模塑科技有限公司 | 执行董事 | 2021年6月至今 | 唯德康医疗子公司 |
| 6 | 宾得医疗科技(江苏)有限公司 | 董事 | 2021年6月至今 | 唯德康医疗参股公司 |
2-2-34
| 序号 | 任职单位 | 职务 | 起止时间 | 是否存在持股情况 |
| 7 | 常州倍瑞诗企业管理有限公司 | 执行董事兼总经理 | 2019年12月至今 | 是 |
| 8 | 常州易博园信息技术有限公司 | 执行董事兼总经理 | 2018年4月至今 | 是 |
| 9 | 常州市依漫生物科技有限公司 | 董事长 | 2018年11月至今 | 是 |
| 10 | 常州慧硒涂层科技有限公司 | 董事 | 2018年7月至今 | 是 |
| 11 | 广东太微加速器有限公司 | 监事 | 2018年6月至今 | 是 |
| 12 | 安徽优尔微测传感技术研究所有限公司 | 监事 | 2013年8月至2018年11月 | 是 |
注:安徽优尔微测传感技术研究所有限公司已于2018年11月27日注销
3、控制的企业和关联企业的基本情况
截至本报告书签署日,庄小金除持有标的公司股权外,控制的企业和主要关联企业的基本情况如下:
| 序号 | 企业名称 | 注册资本(万元) | 持股比例(%) | 主营业务 |
| 1 | 常州倍瑞诗企业管理有限公司 | 500.00 | 51.00 | 投资管理 |
| 2 | 常州易博园信息技术有限公司 | 100.00 | 60.00 | 投资管理 |
| 3 | 常州市依漫生物科技有限公司 | 2,800.00 | 间接持有29.36注1 | 医疗器械环氧乙烷灭菌服务 |
| 4 | 广东太微加速器有限公司 | 1,000.00 | 5.00 | 加速器研发 |
| 5 | 常州慧硒涂层科技有限公司 | 32.00 | 间接持有12.54注2 | 涂层新材料开发 |
| 6 | 常州市武进信诚布厂 | 80.10 | 100.00 | 化纤布,棉布制造、加工 |
| 7 | 常州梓瀞创业投资合伙企业(有限合伙) | 1,000 | 13.27注3 | 员工持股平台 |
| 8 | 常州梓熙创业投资合伙企业(有限合伙) | 1,000 | 12.47注4 | 员工持股平台 |
注1:庄小金通过直接持有常州易博园信息技术有限公司60%股权、直接持有倍瑞诗51%股权间接持有依漫生物股权注2:庄小金通过直接持有常州易博园信息技术有限公司60%股权、间接持有唯德康医疗参股公司常州医疗器械产业研究院有限公司,从而间接持有常州慧硒涂层科技有限公司
12.54%股权
注3:庄小金系常州梓瀞普通合伙人并持有其13.27%合伙份额注4:庄小金系常州梓熙普通合伙人并持有其12.47%合伙份额
2-2-35
(二)缪东林
1、基本情况
| 姓名 | 缪东林 |
| 曾用名 | 无 |
| 性别 | 男 |
| 国籍 | 中国 |
| 证件号码 | 32082619741005**** |
| 住所 | 江苏省常州市武进区湖塘镇**** |
| 通讯地址 | 江苏省常州市武进区湖塘镇**** |
| 是否取得其他国家或地区的居留权 | 否 |
2、最近三年职业和职务及与任职单位存在的产权关系
缪东林最近三年主要任职情况如下:
| 序号 | 任职单位 | 职务 | 起止时间 | 是否存在持股情况 |
| 1 | 江苏唯德康医疗科技有限公司 | 监事、总工程师 | 2012年10月至今 | 是 |
| 2 | 常州市久虹医疗器械有限公司 | 监事、总工程师 | 2010年7月至今 | 唯德康医疗子公司 |
| 3 | 常州锦福瑞医疗器械有限公司 | 监事 | 2017年7月至今 | 唯德康医疗子公司 |
| 4 | 宾得医疗科技(江苏)有限公司 | 董事 | 2021年6月至今 | 唯德康医疗参股公司 |
| 5 | 常州伊斯源企业管理有限公司 | 执行董事兼总经理 | 2019年12月至今 | 是 |
| 6 | 常州易博园信息技术有限公司 | 监事 | 2018年4月至今 | 是 |
| 7 | 常州市依漫生物科技有限公司 | 副董事长 | 2018年7月至今 | 是 |
3、控制的企业和关联企业的基本情况
截至本报告书签署日,缪东林除持有标的公司股权外,控制的企业和主要关联企业的基本情况如下:
| 序号 | 企业名称 | 注册资本(万元) | 持股比例(%) | 主营业务 |
| 1 | 常州伊斯源企业管理有限公司 | 500.00 | 70.00 | 投资管理 |
| 2 | 常州易博园信息技术有限公司 | 100.00 | 40.00 | 投资管理 |
| 3 | 常州市依漫生物科技有 | 2,800.00 | 间接持有26.72注1 | 医疗器械环氧乙 |
2-2-36
| 序号 | 企业名称 | 注册资本(万元) | 持股比例(%) | 主营业务 |
| 限公司 | 烷灭菌服务 | |||
| 4 | 常州慧硒涂层科技有限公司 | 32.00 | 间接持有8.21注2 | 涂层新材料开发 |
注1:缪东林通过直接持有常州易博园信息技术有限公司40%股权、直接持有伊斯源70%股权间接持有依漫生物股权注2:缪东林通过直接持有常州易博园信息技术有限公司40%股权、间接持有唯德康医疗参股公司常州医疗器械产业研究院有限公司,从而间接持有常州慧硒涂层科技有限公司
8.21%股权
二、法人交易对方基本情况
本次发行股份及支付现金购买资产交易包含倍瑞诗和伊斯源两名法人股东,两名法人股东的基本情况如下:
(一)倍瑞诗
1、基本情况
| 公司名称 | 常州倍瑞诗企业管理有限公司 |
| 统一社会信用代码 | 91320412MA20NU6D2K |
| 住 所 | 常州西太湖科技产业园兰香路8号1号楼201室 |
| 公司类型 | 有限责任公司 |
| 经营范围 | 企业管理咨询;品牌策划;市场策划;市场调研、市场推广;医疗器械的技术咨询、技术开发、技术转让;文化艺术交流;会务服务;展览展示服务;工艺美术品销售。(依法须经批准的项目,经相关部门批准后方可开展经营活动) |
| 注册资本 | 500万元人民币 |
| 法定代表人 | 庄小金 |
| 营业期限 | 2019-12-24 至 无固定期限 |
| 成立日期 | 2019-12-24 |
2、历史沿革
2019年12月23日,倍瑞诗由庄小金和宋银萍共同以货币方式出资设立。2019年12月24日,倍瑞诗在江苏省常州市武进区行政审批局登记成立,并取得了《营业执照》,注册资本为500万元人民币。
3、产权及控制关系
截至本报告书签署日,倍瑞诗股权结构情况如下,其中庄小金及宋银萍系
2-2-37
夫妻关系:
| 序号 | 股东名称 | 出资额(万元) | 出资比例(%) | 股东性质 |
| 1 | 庄小金 | 255.00 | 51.00 | 境内自然人 |
| 2 | 宋银萍 | 245.00 | 49.00 | 境内自然人 |
| 合计 | 500.00 | 100.00 | - | |
4、最近三年主营业务发展情况
自成立至今,倍瑞诗主要从事投资管理业务。
5、最近两年一期主要财务数据
倍瑞诗最近两年一期未经审计主要财务数据如下:
单位:万元
| 项目 | 2021年6月30日/ 2021年1-6月 | 2020年12月31日/2020年度 | 2019年12月31日 /2019年度 |
| 资产总额 | 14,682.72 | 3,210.10 | - |
| 负债总额 | 8.61 | 45.49 | - |
| 股东权益合计 | 14,674.11 | 3,164.61 | - |
| 营业收入 | - | - | - |
| 净利润 | 11,509.50 | 2,784.61 | - |
6、下属企业情况
截至本报告书签署日,倍瑞诗除持有标的公司股权外,其他下属企业情况如下:
| 序号 | 企业名称 | 注册资本 (万元) | 持股比例(%) | 主营业务 |
| 1 | 常州市依漫生物科技有限公司 | 2,800.00 | 56.40 | 医疗器械环氧乙烷灭菌服务 |
(二)伊斯源
1、基本情况
| 公司名称 | 常州伊斯源企业管理有限公司 |
| 统一社会信用代码 | 91320412MA20P5FD2F |
| 住 所 | 常州西太湖科技产业园兰香路8号1号楼202室 |
2-2-38
| 公司类型 | 有限责任公司 |
| 经营范围 | 企业管理咨询;品牌策划;市场策划;市场调研、市场推广;医疗器械的技术咨询、技术开发、技术转让;文化艺术交流;会务服务;展览展示服务;工艺美术品销售。(依法须经批准的项目,经相关部门批准后方可开展经营活动) |
| 注册资本 | 500万元人民币 |
| 法定代表人 | 缪东林 |
| 营业期限 | 2019-12-25 至 无固定期限 |
| 成立日期 | 2019-12-25 |
2、历史沿革
2019年12月24日,伊斯源由缪东林和王小苹共同以货币方式出资设立。2019年12月25日,倍瑞诗在江苏省常州市武进区行政审批局登记成立,并取得了《营业执照》,注册资本为500万元人民币。
3、产权及控制关系
截至本报告书签署日,伊斯源股权结构情况如下,其中缪东林及王小苹系夫妻关系:
| 序号 | 股东名称 | 出资额(万元) | 出资比例(%) | 股东性质 |
| 1 | 缪东林 | 350.00 | 70.00 | 境内自然人 |
| 2 | 王小苹 | 150.00 | 30.00 | 境内自然人 |
| 合计 | 500.00 | 100.00 | - | |
4、最近三年主营业务发展情况
自成立至今,伊斯源主要从事投资管理业务。
5、最近两年一期主要财务指标
伊斯源最近两年一期未经审计主要财务数据如下:
单位:万元
| 项目 | 2021年6月30日/ 2021年1-6月 | 2020年12月31日 /2020年度 | 2019年12月31日 /2019年度 |
| 资产总额 | 4,350.58 | 891.35 | - |
| 负债总额 | 502.57 | 0.03 | - |
| 股东权益合计 | 3,848.01 | 891.31 | - |
2-2-39
| 项目 | 2021年6月30日/ 2021年1-6月 | 2020年12月31日 /2020年度 | 2019年12月31日 /2019年度 |
| 营业收入 | - | - | - |
| 净利润 | 2,956.70 | 628.31 | - |
6、下属企业情况
截至本报告书签署日,伊斯源除持有标的公司股权外,其他下属企业情况如下:
| 序号 | 企业名称 | 注册资本 (万元) | 持股比例(%) | 主营业务 |
| 1 | 常州市依漫生物科技 有限公司 | 2,800.00 | 37.60 | 医疗器械环氧乙烷灭菌服务 |
三、其他事项说明
(一)交易对方之间的关联关系
本次发行股份及支付现金购买资产的交易对方中,倍瑞诗系庄小金控制的企业,伊斯源系缪东林控制的企业。
(二)交易对方与上市公司的关联关系
本次发行股份及支付现金购买资产的交易对方在本次交易前未持有上市公司股份,与上市公司之间不存在关联关系;本次交易完成后,各交易对方持有上市公司股份低于5%,与上市公司不构成关联关系。
(三)交易对方向上市公司推荐董事或高级管理人员的说明
截至本报告书签署日,本次发行股份及支付现金购买资产的交易对方未向上市公司推荐董事及高级管理人员。
(四)交易对方及其主要管理人员最近五年合法合规情况
截至本报告书签署日,发行股份及支付现金购买资产的交易对方及其主要管理人员最近五年内不存在受过行政处罚(与证券市场明显无关的除外)、刑事处罚、或者涉及与经济纠纷有关的重大民事诉讼或者仲裁的情形。
2-2-40
(五)交易对方及其主要管理人员最近五年的诚信情况
截至本报告书签署日,发行股份及支付现金购买资产的交易对方及其主要管理人员不存在未按期偿还大额债务、未履行承诺、被中国证监会采取行政监管措施或受到证券交易所纪律处分等情况。
2-2-41
第四节 交易标的基本情况
一、交易标的基本信息
| 公司名称 | 江苏唯德康医疗科技有限公司 |
| 统一社会信用代码 | 913204120551881197 |
| 住 所 | 江苏武进经济开发区果香路52号 |
| 公司类型 | 有限责任公司 |
| 经营范围 | 三类医疗器械生产(按照《医疗器械生产许可证》核定范围生产);二类医疗器械生产(按照《医疗器械生产许可证》核定范围生产)和销售;一类医疗器械的研发、销售;自营和代理各类商品及技术的进出口业务,国家限定企业经营或禁止进出口的商品及技术除外。(依法须经批准的项目,经相关部门批准后方可开展经营活动)一般项目:日用口罩(非医用)生产;日用口罩(非医用)销售(除依法须经批准的项目外,凭营业执照依法自主开展经营活动) |
| 注册资本 | 8,188.0092万元人民币 |
| 法定代表人 | 庄小金 |
| 营业期限 | 2012-10-15 至 2032-10-14 |
| 成立日期 | 2012-10-15 |
二、交易标的历史沿革
(一)历史沿革
1、唯德康医疗设立情况
2012年10月15日,唯德康医疗在常州市武进工商行政管理局登记成立,并取得了《营业执照》(注册号320483000352440),注册资本为1,000万元人民币。
唯德康医疗设立时的股权结构如下:
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 缪东林 | 300.00 | 30.00 |
| 2 | 宋银萍 | 700.00 | 70.00 |
| 合计 | 1,000.00 | 100.00 | |
2-2-42
2、2020年2月,第一次增资
2019年12月10日,唯德康医疗召开股东会,决议增加注册资本,原注册资本为1,000万元变更为注册资本3,000万元,净增注册资本2,000万元,分别由新股东倍瑞诗认缴出资1,400万元;由新股东伊斯源认缴出资600万元;原股东宋银萍、缪东林认缴出资额不变。2020年2月21日,常州市武进区行政审批局准予此次变更,核发了变更后的营业执照。上述增资完成后,唯德康医疗股权结构如下:
| 序号 | 名称/姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 倍瑞诗 | 1,400.00 | 46.67 |
| 2 | 伊斯源 | 600.00 | 20.00 |
| 3 | 宋银萍 | 700.00 | 23.33 |
| 4 | 缪东林 | 300.00 | 10.00 |
| 合计 | 3,000.00 | 100.00 | |
3、2021年3月,第二次增资及第一次股权转让
2021年3月23日,唯德康医疗召开股东会,决议增加注册资本,原注册资本由30,000,000元增加为81,880,092元,净增注册资本51,880,092元,分别由庄小金认缴出资40,410,069元;由缪东林认缴出资11,470,023元。决议在前述增资完成基础上进行股权转让,同意股东倍瑞诗将其持有的部分出资额4,094,004.6元转让给常州梓瀞,将其持有的部分出资额2,047,002.3元转让给常州梓熙;同意股东伊斯源将其持有的部分出资额2,047,002.3元转让给常州梓熙。
同日,本次增资的各方签署了增资协议,其中庄小金增资人民币98,705,479.54元,缪东林增资人民币28,016,634.09元,上述增资价格系参照唯德康医疗收购完成久虹医疗以及本次增资完成后的净资产水平确定。本次股权转让的各方签署了股权转让协议,其中常州梓瀞以人民币10,000,000元受让倍瑞诗持有的出资额4,094,004.6元,占比5%;常州梓熙以人民币10,000,000元合计受让倍瑞诗持有的出资额2,047,002.3元和伊斯源持有的出资额2,047,002.3元,合计占比5%;常州梓瀞和常州梓熙系唯德康医疗员工持股平台,上述转让价格根据同次增资价格予以确定。
2-2-43
2021年3月24日,常州市武进区行政审批局准予此次变更,核发了变更后的营业执照。
2021年3月29日,常州中瑞会计师事务所有限公司出具《验资报告》(文号:常中瑞会验[2021]第21号),经审验,截至2021年3月26日止,唯德康医疗已收到全体股东缴纳的新增注册资本(实收资本)合计人民币7,188.0092万元,其中本次新增注册资本人民币5,188.0092万元,出资方式全部为货币。
截至2021年3月26日,唯德康医疗的累计注册资本为人民币8,188.0092万元,实收资本为人民币8,188.0092万元,唯德康医疗认缴出资已全部实缴完毕。
上述增资及转让事项完成后,唯德康医疗股权结构如下:
| 序号 | 名称/姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 倍瑞诗 | 785.89931 | 9.60 |
| 2 | 伊斯源 | 395.29977 | 4.83 |
| 3 | 宋银萍 | 700.00 | 8.55 |
| 4 | 缪东林 | 1,447.0023 | 17.67 |
| 5 | 庄小金 | 4,041.0069 | 49.35 |
| 6 | 常州梓瀞 | 409.40046 | 5.00 |
| 7 | 常州梓熙 | 409.40046 | 5.00 |
| 合计 | 8,188.0092 | 100.00 | |
4、标的公司历次增减资及股权转让汇总情况
标的公司自成立以来历次增减资及股权转让情况汇总如下:
| 序号 | 日期 | 增资及股权转让内容 | 增资及转让原因 | 作价依据 | 股权变动相关方关联关系 |
| 1 | 2020年2月 | 标的公司新增注册资本2,000万元,由倍瑞诗及伊斯源认缴 | 原股东基于家庭资产配置考虑,进行同比例增资 | 1元/注册资本 | 倍瑞诗系庄小金控制的企业;伊斯源系缪东林控制的企业 |
| 2 | 2021年3月 | 标的公司新增注册资本51,880,092元,由庄小金及缪东林认缴 | 内部重组,原股东进行股权比例调整 | 2.44元/注册资本,系参照届时唯德康医疗收购完成久虹医疗以及本次增资完成后的净资产水平确定 | 庄小金及缪东林均为原股东 |
2-2-44
| 序号 | 日期 | 增资及股权转让内容 | 增资及转让原因 | 作价依据 | 股权变动相关方关联关系 |
| 3 | 2021年3月 | 倍瑞诗将其持有的部分出资额4,094,004.6元转让给常州梓瀞,将其持有的部分出资额2,047,002.3元转让给常州梓熙;伊斯源将其持有的部分出资额2,047,002.3元转让给常州梓熙 | 设立员工持股平台,实现员工股权激励 | 2.44元/注册资本,系参考同次增资价格 | 常州梓瀞与常州梓熙均系标的公司员工持股平台 |
(二)标的公司内部重组情况
唯德康医疗之下属子公司久虹医疗原为唯德康医疗之兄弟公司,上述主体主营业务均为内镜诊疗器械的研发、生产及销售。为有效整合相关业务及资产,简化与上市公司重组交易安排,唯德康医疗于2021年3月通过现金收购方式实现与久虹医疗的内部重组,具体情况如下:
2021年3月17日,唯德康医疗召开股东会,同意唯德康医疗现金收购倍瑞诗、伊斯源、庄小金及缪东林持有的常州市久虹医疗器械有限公司100%的股权,其中倍瑞诗转让其持有的出资额1,120万元,占比70%;伊斯源转让其持有的出资额280万元,占比17.5%;庄小金转让其持有的出资额160万元,占比10%;缪东林转让其持有的出资额40万元,占比2.5%。上述收购完成后,唯德康医疗持有久虹医疗100%的股权。
2021年3月17日,东洲评估出具《常州市久虹医疗器械有限公司拟股权转让所涉及的股东全部权益价值资产评估报告》(东洲评报字【2021】第0388号),本次评估采用资产基础法对久虹医疗股东全部权益价值进行评估,确认以2020年12月31日为评估基准日,久虹医疗股东全部权益价值为人民币3,672.21万元。
同日,本次股权转让的各方签署了本次股权转让协议,确认本次股权转让价格为评估值人民币3,672.21万元。久虹医疗股东会作出决议,同意上述转股事宜。
2021年3月23日,常州市武进区工商行政审批局准予此次变更,核发了久虹医疗股东变更后的营业执照。
2-2-45
上述股权转让完成后,久虹医疗股权结构如下:
| 序号 | 名称 | 出资额(万元) | 出资比例(%) |
| 1 | 唯德康医疗 | 1,600.00 | 100.00 |
| 合计 | 1,600.00 | 100.00 | |
(三)出资及合法存续情况
截至本报告书签署日,上市公司拟购买的标的资产股权权属清晰,不存在抵押、质押等权利限制,不涉及诉讼、仲裁、司法强制执行等重大争议或者存在妨碍权属转移的其他情况。截至本报告书签署日,唯德康医疗自成立以来的历次股权变动已履行了必要的审批或确认程序,其主体资格合法、有效,现时不存在因营业期限届满、股东会决议、合并或分立等事项应予解散的情形,不存在因不能清偿到期债务依法宣告破产、严重违反法律法规被依法吊销营业执照、责令关闭或者被撤销等应予终止的情形,不存在出资瑕疵或影响其合法存续的情形。
三、交易标的股权结构及控制关系
(一)股权结构
截至本报告书签署日,唯德康医疗的股权结构及控制关系如下图所示,其中宋银萍系庄小金配偶,王小苹系缪东林配偶。
(二)控股股东及实际控制人
截至本报告书签署日,标的公司的控股股东及实际控制人均为庄小金先生。庄小金先生具体情况详见本报告书“第三节 交易对方基本情况”之“一、自然
2-2-46
人交易对方基本情况”。
(三)公司章程中可能对本次交易产生影响的主要内容或相关投资协议截至本报告书签署日,标的公司的公司章程中不存在对本次交易产生影响的主要内容,标的公司各股东之间不存在对本次交易产生影响的相关投资协议。
(四)高级管理人员的安排
截至本报告书签署日,唯德康医疗原高级管理人员不存在特别安排事宜,原则上仍沿用原有的管理机构和管理人员。若实际经营需要,将在遵守相关法律法规和其公司章程的情况下进行调整。
(五)影响该资产独立性的协议或其他安排
截至本报告书签署日,唯德康医疗不存在影响其资产独立性的协议或其他安排。
四、交易标的下属公司情况
截至本报告书签署日,标的公司共计拥有6家控股子公司及2家参股公司,其中控股子公司分别为久虹医疗、锦福瑞医疗、图云医疗、常州市恒可模塑科技有限公司、Vedkang GmbH、VD-JH GmbH,参股公司为常州医疗器械产业研究院有限公司及宾得医疗科技(江苏)有限公司。其中久虹医疗和锦福瑞医疗因最近一期经审计的资产总额、营业收入、净资产额或净利润指标占标的公司20%以上,构成标的公司的重要子公司。Vedkang GmbH系唯德康医疗境外子公司,已处于注销阶段。标的公司主要下属企业基本信息情况如下:
(一)久虹医疗
1、基本情况
| 公司名称 | 常州市久虹医疗器械有限公司 |
| 统一社会信用代码 | 91320412752715041C |
| 住 所 | 武进区湖塘镇鸣新中路256号 |
| 公司类型 | 有限责任公司 |
| 经营范围 | 三类医疗器械生产(按照《医疗器械生产许可证》核定范围生产)和销售;二类医疗器械生产(按照《医疗器械生产许可证》 |
2-2-47
| 核定范围生产)和销售;一类医疗器械的研发、销售。自营和代理各类商品及技术的进出口业务,国家限定企业经营或禁止进出口的商品及技术除外。医用口罩生产;医用口罩零售;医用口罩批发;日用口罩(非医用)生产;日用口罩(非医用)销售;(依法须经批准的项目,经相关部门批准后方可开展经营活动) | |
| 注册资本 | 1,600万元人民币 |
| 法定代表人 | 庄小金 |
| 营业期限 | 2003-07-28至2033-07-27 |
| 成立日期 | 2003-07-28 |
2、历史沿革
(1)2003年7月,久虹医疗设立
2003年7月18日,久虹医疗由庄小金、缪东林及袁肖荣共同以货币方式出资设立。7月28日,久虹医疗在江苏省常州工商行政管理局登记成立,并取得了《营业执照》(注册号3204832106802),注册资本为60万元人民币,营业期限自2003年7月28日至2013年7月27日。
2003年7月22日,常州市永嘉会计师事务所有限公司出具编号为常永嘉验(2003)第0156号的验资报告,证明截至2003年7月22日止,久虹医疗已收到全体股东缴纳的注册资本合计60.00万元。
久虹医疗设立时的股权结构如下:
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 袁肖荣 | 20.04 | 33.40 |
| 2 | 庄小金 | 19.98 | 33.30 |
| 3 | 缪东林 | 19.98 | 33.30 |
| 合计 | 60.00 | 100.00 | |
(2)2004年12月,久虹医疗第一次股权转让
2004年11月30日,久虹医疗召开股东会,决议通过:股东袁肖荣将其在久虹医疗出资5.73万元转让给股东庄小金、出资3万元转让给新股东刘贤刚;股东缪东林将其在久虹医疗出资7.764万元转让给股东庄小金。同日,协议各方签署了《股权转让协议》。
2-2-48
2004年12月9日,常州市武进工商行政管理局核准此次变更,核发了变更后的营业执照。
上述股权转让完成后,久虹医疗股权结构如下:
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 袁肖荣 | 11.310 | 18.85 |
| 2 | 庄小金 | 33.474 | 55.79 |
| 3 | 缪东林 | 12.216 | 20.36 |
| 4 | 刘贤刚 | 3.000 | 5.00 |
| 合计 | 60.00 | 100.00 | |
(3)2005年12月,久虹医疗第二次股权转让
2005年11月24日,久虹医疗召开股东会,决议通过:股东刘贤刚将其所持出资3万元转让给庄小金。同日,协议双方签署了《股权转让协议》。
2005年12月6日,常州市武进工商行政管理局准予此次变更,核发了变更后的营业执照。
上述股权转让完成后,久虹医疗股权结构如下:
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 袁肖荣 | 11.310 | 18.85 |
| 2 | 庄小金 | 36.474 | 60.79 |
| 3 | 缪东林 | 12.216 | 20.36 |
| 合计 | 60.00 | 100.00 | |
(4)2006年4月,久虹医疗第三次股权转让
2006年3月17日,久虹医疗召开股东会,决议通过:股东缪东林将其所持出资12.216万元转让给庄小金。同日,协议双方签署了《股权转让协议》。
2006年4月17日,常州市武进工商行政管理局准予此次变更,核发了变更后的营业执照。
上述股权转让完成后,久虹医疗股权结构如下:
2-2-49
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 袁肖荣 | 11.31 | 18.85 |
| 2 | 庄小金 | 48.69 | 81.15 |
| 合计 | 60.00 | 100.00 | |
(5)2006年7月,久虹医疗第四次股权转让
2006年6月30日,久虹医疗召开股东会,决议通过:袁肖荣将其出资11.31万元全额转让给新股东吴菊英。同日,协议双方签署了《股权转让协议》。2006年7月6日,常州市武进工商行政管理局准予此次变更,核发了变更后的营业执照。
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 吴菊英 | 11.31 | 18.85 |
| 2 | 庄小金 | 48.69 | 81.15 |
| 合计 | 60.00 | 100.00 | |
(6)2007年10月,久虹医疗第一次增资
2007年10月28日,久虹医疗召开股东会,决议通过:变更增加注册资本,由原注册资本为60万元,变更为200万元,由股东庄小金增加出资140万元。变更注册资本后各股东出资情况为:股东庄小金出资188.69万元,股东吴菊英出资11.31万元。
2007年10月31日,常州方正会计师事务所有限公司出具编号为常方会验(2007)第0196号的验资报告,证明截至2007年10月31日止,久虹医疗已收到股东缴纳的新增注册资本合计人民币140.00万元。
2007年11月1日,常州市武进工商行政管理局准予此次变更,核发了变更后的营业执照。
上述增资完成后,久虹医疗股权结构如下:
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 吴菊英 | 11.31 | 5.65 |
| 2 | 庄小金 | 188.69 | 94.35 |
2-2-50
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 合计 | 200.00 | 100.00 | |
(7)2010年7月,久虹医疗第五次股权转让
2010年7月6日,久虹医疗召开股东会,决议通过:股东庄小金将其出资40万元转让给新股东缪东林,股东吴菊英将其出资11.31万元转让给股东庄小金。同日,协议各方签署了《股权转让协议》。
2010年7月20日,常州市武进工商行政管理局准予此次变更,核发了变更后的营业执照。
上述股权转让完成后,久虹医疗股权结构如下:
| 序号 | 姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 缪东林 | 40.00 | 20.00 |
| 2 | 庄小金 | 160.00 | 80.00 |
| 合计 | 200.00 | 100.00 | |
(8)2020年2月,久虹医疗第二次增资
2019年12月10日,久虹医疗召开股东会,决议通过:(1)决定增加倍瑞诗、伊斯源为股东。(2)决定增加注册资本,原注册资本为200万元,现变更为注册资本1,600万元,净增注册资本1,400万元,分别由股东倍瑞诗增加出资1,120万元;由股东伊斯源增加出资280万元。
2020年2月21日,常州市武进区行政审批局准予此次变更,核发了变更后的营业执照。
上述增资完成后,久虹医疗股权结构如下:
| 序号 | 名称/姓名 | 出资额(万元) | 出资比例(%) |
| 1 | 倍瑞诗 | 1,120.00 | 70.00 |
| 2 | 伊斯源 | 280.00 | 17.50 |
| 3 | 庄小金 | 160.00 | 10.00 |
| 4 | 缪东林 | 40.00 | 2.50 |
| 合计 | 1,600.00 | 100.00 | |
2-2-51
(9)2021年3月,久虹医疗第六次股权转让
2021年3月17日,久虹医疗召开股东会,同意股东倍瑞诗、伊斯源、庄小金及缪东林将其持有的公司100%的股权转让至唯德康医疗。同日,协议各方签署了《股权转让协议》。
2021年3月23日,常州市武进区行政审批局准予此次变更,核发了变更后的营业执照。
上述转让完成后,久虹医疗股权结构如下:
| 序号 | 股东名称 | 出资额(万元) | 出资比例(%) |
| 1 | 唯德康医疗 | 1,600.00 | 100.00 |
| 合计 | 1,600.00 | 100.00 | |
3、股权结构及控制关系
截至本报告书签署日,久虹医疗系唯德康医疗100%持股。
4、出资及合法存续情况
截至本报告书签署日,上市公司拟购买的唯德康医疗所持有的久虹医疗100%股权权属清晰,不存在抵押、质押等权利限制,不涉及诉讼、仲裁、司法强制执行等重大争议或者存在妨碍权属转移的其他情况。
截至本报告书签署日,久虹医疗自成立以来的历次股权变动已履行了必要的审批或确认程序,其主体资格合法、有效,现时不存在因营业期限届满、股东会决议、合并或分立等事项应予解散的情形,不存在因不能清偿到期债务依法宣告破产、严重违反法律法规被依法吊销营业执照、责令关闭或者被撤销等应予终止的情形,不存在出资瑕疵或影响其合法存续的情形。
5、最近三年主营业务情况
久虹医疗主营业务为专业从事消化内镜领域医疗器械研发、生产、销售,旗下拥有“久虹”品牌系列产品。
6、最近两年一期主要财务指标情况
报告期内,久虹医疗经审计的主要财务指标情况如下:
2-2-52
单位:万元
| 项目 | 2021年6月30日 /2021年1-6月 | 2020年12月31日 /2020年度 | 2019年12月31日 /2019年度 |
| 资产总额 | 7,355.48 | 19,592.80 | 18,467.73 |
| 负债总额 | 4,296.82 | 18,610.04 | 5,380.66 |
| 股东权益合计 | 3,058.66 | 982.76 | 13,087.07 |
| 营业收入 | 8,659.44 | 22,108.62 | 16,712.38 |
| 净利润 | 1,760.33 | 6,017.08 | 4,149.44 |
(二)锦福瑞医疗
1、基本情况
| 公司名称 | 常州锦福瑞医疗器械有限公司 |
| 统一社会信用代码 | 91320412MA1PCNAK7K |
| 住 所 | 常州市武进区西太湖科技产业园长扬路9号F1栋411室、412室、425室 |
| 公司类型 | 有限责任公司 |
| 经营范围 | 三类医疗器械销售(按照《医疗器械经营许可证》核定范围销售); 二类医疗器械销售;一类医疗器械销售;会议及展览服务;市场推广服务及企业营销策划;自营和代理各类商品及技术的进出口业务,国家限定企业经营或禁止进出口的商品及技术除外。(依法须经批准的项目,经相关部门批准后方可开展经营活动) |
| 注册资本 | 500万元人民币 |
| 法定代表人 | 曹贺 |
| 营业期限 | 2017-07-11 至 无固定期限 |
| 成立日期 | 2017-07-11 |
| 股权结构 | 唯德康医疗持股100% |
2、历史沿革
(1)2017年7月,锦福瑞医疗设立
2017年7月3日,锦福瑞医疗由唯德康医疗以货币方式出资设立。2017年7月11日,锦福瑞医疗在常州市武进区市场监督管理局登记成立,并取得了《营业执照》(统一社会信用代码91320412MA1PCNAK7K),注册资本为100万元人民币。
锦福瑞医疗设立时的股权结构如下:
2-2-53
| 序号 | 股东名称 | 出资额(万元) | 出资比例(%) |
| 1 | 江苏唯德康医疗科技有限公司 | 100.00 | 100.00 |
| 合计 | 100.00 | 100.00 | |
(2)2018年6月,锦福瑞医疗第一次增资
2018年6月5日,锦福瑞医疗召开股东会,会议通过如下决议:决定增加注册资本,原注册资本为100万元现变更为注册资本500万元,净增注册资本400万元,仍由唯德康医疗认缴新增注册资本。
2018年6月11日,常州市武进区市场监督管理局准予此次变更,核发了变更后的营业执照。
上述增资完成后,锦福瑞医疗股权结构如下:
| 序号 | 股东名称 | 出资额(万元) | 出资比例(%) |
| 1 | 江苏唯德康医疗科技有限公司 | 500.00 | 100.00 |
| 合计 | 500.00 | 100.00 | |
3、股权结构及控制关系
截至本报告书签署日,锦福瑞医疗系唯德康医疗100%持股。
4、出资及合法存续情况
截至本报告书签署日,上市公司拟购买的唯德康医疗所持有的锦福瑞医疗100%股权权属清晰,不存在抵押、质押等权利限制,不涉及诉讼、仲裁、司法强制执行等重大争议或者存在妨碍权属转移的其他情况。
截至本报告书签署日,锦福瑞医疗自成立以来的历次股权变动已履行了必要的审批或确认程序,其主体资格合法、有效,现时不存在因营业期限届满、股东会决议、合并或分立等事项应予解散的情形,不存在因不能清偿到期债务依法宣告破产、严重违反法律法规被依法吊销营业执照、责令关闭或者被撤销等应予终止的情形,不存在出资瑕疵或影响其合法存续的情形。
5、最近三年主营业务情况
锦福瑞医疗自成立以来主要从事唯德康医疗及久虹医疗系列产品的销售,
2-2-54
此外锦福瑞医疗代理M.I.TECH CO., LTD旗下金属支架产品的境内经销业务。
6、最近两年一期主要财务指标情况
报告期内,锦福瑞医疗经审计的主要财务指标情况如下:
单位:万元
| 项目 | 2021年6月30日 /2021年1-6月 | 2020年12月31日 /2020年度 | 2019年12月31日 /2019年度 |
| 资产总额 | 4,311.18 | 2,184.56 | 546.04 |
| 负债总额 | 3,551.71 | 1,065.17 | 153.44 |
| 股东权益合计 | 759.48 | 1,119.39 | 392.60 |
| 营业收入 | 10,767.97 | 7,675.68 | 965.53 |
| 净利润 | 640.08 | 726.79 | 203.06 |
(三)图云医疗
| 1、基本情况公司名称 | 江苏图云医疗科技有限公司 |
| 统一社会信用代码 | 91320412MA25771F1E |
| 住 所 | 常州西太湖科技产业园兰香路8号石墨烯产业园9号楼四楼 |
| 公司类型 | 有限责任公司 |
| 经营范围 | 许可项目:第三类医疗器械生产;第二类医疗器械生产;第三类医疗器械经营;技术进出口;货物进出口(依法须经批准的项目,经相关部门批准后方可开展经营活动,具体经营项目以审批结果为准)一般项目:技术服务、技术开发、技术咨询、技术交流、技术转让、技术推广;第一类医疗器械生产;第一类医疗器械销售;第二类医疗器械销售;机械设备销售;机械设备研发;电气设备修理(除依法须经批准的项目外,凭营业执照依法自主开展经营活动) |
| 注册资本 | 1,000万元人民币 |
| 法定代表人 | 庄小金 |
| 营业期限 | 2021-02-08 至 2051-02-07 |
| 成立日期 | 2021-02-08 |
| 股权结构 | 唯德康医疗持股80%,常州信创智诚创业投资合伙企业(有限合伙)持股20% |
(四)常州市恒可模塑科技有限公司
| 公司名称 | 常州市恒可模塑科技有限公司 |
| 统一社会信用代码 | 91320412MA26BPMK8Y |
| 住 所 | 江苏武进经济开发区长汀路502号D栋1楼东南 |
| 公司类型 | 有限责任公司 |
2-2-55
| 成立日期 | 2021年06月22日 |
| 营业期限 | 2021年06月22日至无固定期限 |
| 法定代表人 | 庄小金 |
| 经营范围 | 许可项目:货物进出口(依法须经批准的项目,经相关部门批准后方可开展经营活动,具体经营项目以审批结果为准)一般项目:技术服务、技术开发、技术咨询、技术交流、技术转让、技术推广;塑料制品制造;塑料制品销售;模具制造;模具销售;机械零件、零部件加工;机械零件、零部件销售;五金产品制造;弹簧制造(除依法须经批准的项目外,凭营业执照依法自主开展经营活动) |
| 注册资本 | 500万元人民币 |
| 股权结构 | 唯德康医疗100% |
(五)Vedkang GmbH
| 公司名称 | Vedkang GmbH |
| 曾用名 | Vemed GmbH(于2017年9月变更) |
| 公司注册号 | HRB 77697 |
| 注册地址 | Brehmstrasse 56, 40239 Düsseldorf |
| 公司类型 | 有限责任公司 |
| 成立日期 | 2016年5月17日 |
| 经营目的 | 各类货物的进出口及贸易,尤其是医疗产品 |
| 注册资本 | 25,000欧元 |
| 股权结构 | 唯德康医疗100% |
经查询根据德国联邦司法部行政命令管理的“公司注册”(CompanyRegister)平台网站(www.unternehmensregister.de/ureg/),以及杜塞尔多夫地方法院于2018年10月24日发给Vedkang GmbH的信函,Vedkang GmbH已解散,解散登记日为2018年10月23日。
解散后,Vedkang GmbH指定清算人已于2018年11月6日在德国联邦公报刊登解散公告,并要求债权人进行申报,申报期间未收到债权人申报,前述“锁定年”期间(自要求债权人申报之日起一年)已于2019年11月5日结束;目前Vedkang GmbH的税务清算工作正在进行中。
根据常州市商务局于2018年12月26日出具的《企业境外投资注销确认函》,“该境外企业(Vedkang GmbH)已注销,证书已收回作废”。
2-2-56
(六)VD-JH GmbH
| 公司名称 | VD-JH GmbH |
| 公司注册号 | HRB 95062 |
| 注册地址 | Grafenberger Allee 293, 40237 Düsseldorf |
| 公司类型 | 有限责任公司 |
| 成立日期 | 2021年10月5日 |
| 经营范围 | 医疗器械设备、尤其是医用光学器具、医用仪器、内窥镜以及医用耗材和医用高分子材料及其制品的进出口贸易,须经批准的危险或违禁物品除外;以及上述产品的售后维护及产品咨询服务,须经批准的法律和税务咨询服务除外。 |
| 注册资本 | 50,000欧元 |
| 股权结构 | 唯德康医疗持股100% |
(七)常州医疗器械产业研究院有限公司
| 公司名称 | 常州医疗器械产业研究院有限公司 |
| 统一社会信用代码 | 91320412301907503Q |
| 住 所 | 江苏武进经济开发区长扬路9号E4座 |
| 公司类型 | 有限责任公司 |
| 经营范围 | 医疗器械方面的技术研发、专业检测、专业人才培训,医疗器械技术咨询,医疗器械会展策划,一类医疗器械的制造、销售。 |
| 注册资本 | 1,000万元人民币 |
| 法定代表人 | 朱伟中 |
| 营业期限 | 2014-05-05 至 2029-05-04 |
| 成立日期 | 2014-05-05 |
| 股权结构 | 江苏新天地投资集团有限公司持股50%、江苏慧德科技发展有限公司持股27%、常州市延陵电子设备有限公司持股5%、唯德康医疗持股5%、常州好利医用品有限公司持股5%、福隆医疗器械集团有限公司持股5%、王岷颜持股3% |
(八)宾得医疗科技(江苏)有限公司
| 公司名称 | 宾得医疗科技(江苏)有限公司 |
| 统一社会信用代码 | 91320412MA26DLEG4H |
| 住 所 | 常州西太湖科技产业园禾香路123号7号楼C区三楼 |
| 公司类型 | 有限责任公司(外商投资、非独资) |
| 经营范围 | 许可项目:第三类医疗器械生产;第三类医疗器械经营;第二类医疗器械生产;技术进出口;货物进出口(依法须经批准的项目,经相关部门批准后方可开展经营活动,具体经营项目以审批结果为准)一般项目:技术服务、技术开发、技术咨询、 |
2-2-57
| 技术交流、技术转让、技术推广;第二类医疗器械销售;第一类医疗器械生产;第一类医疗器械销售(除依法须经批准的项目外,凭营业执照依法自主开展经营活动) | |
| 注册资本 | 300万美元 |
| 法定代表人 | 何琼 |
| 营业期限 | 2021-06-29至无固定期限 |
| 成立日期 | 2021-06-29 |
| 股权结构 | 唯德康医疗49%以及HOYA株式会社51% |
五、最近三年股权转让、增减资及资产评估或估值情况
(一)最近三年股权转让、增减资情况
截至本报告书签署日,标的公司最近三年股权转让及增减资情况详见本节之“二、交易标的历史沿革”。
(二)最近三年资产评估情况
除本次交易外,最近三年标的公司未进行资产评估,其下属子公司合计进行了两次资产评估,具体情况如下:
1、剥离依漫生物
2021年3月11日,依漫生物召开股东会,一致形成如下决议:全体股东经讨论同意股东久虹医疗将其持有的依漫生物56.40%的股权转让至倍瑞诗,将其持有的依漫生物37.60%的股权转让至伊斯源。转让各方于同日签署了《股权转让协议》。2021年3月18日,常州市武进区行政审批局准予此次变更,核发了变更后的营业执照。
(1)久虹医疗剥离依漫生物的原因
依漫生物成立于2018年7月,主要从事医疗产品灭菌加工服务,剥离之前,依漫生物尚处于建设期,未实际投入运营且处于亏损状态。2021年4月开始,依漫生物进行试运营。
本次交易之前,对依漫生物进行了剥离,主要是基于:1)依漫生物后续拟为周边地区医疗器械企业提供专业化灭菌服务,其发展相对独立。医疗器械产品灭菌加工服务属于重资产运营项目,后期投入大、建设周期长,且科技含量
2-2-58
不高,利润率较低,基于聚焦医疗器械产品生产销售主业的考虑,将依漫生物置出进行独立运营,并拓展其他医疗器械企业灭菌业务,更有利于发挥规模优势;2)报告期内,唯德康医疗主要采用自行灭菌,辅以部分委托外部单位灭菌,随着环保要求的提升,唯德康医疗将全面采用委托外部单位灭菌的方式对产品进行灭菌,在常州周边地区,已有成熟的医疗产品灭菌加工服务企业,剥离依漫生物不会成为唯德康医疗生产经营的限制因素,依漫生物投入正式运营以后,将会成为唯德康医疗新的可供选择的灭菌服务供应商之一,本次剥离不会影响双方业务的开展。
(2)依漫生物评估情况
依漫生物主营业务为医疗产品灭菌加工服务,报告期内,依漫生物尚未实际开展经营。根据东洲评估出具的《常州市久虹医疗器械有限公司拟转让常州市依漫生物科技有限公司股权涉及的股东全部权益价值资产评估报告》(东洲评报字【2021】第0346号),本次评估采用资产基础法对依漫生物股东全部权益价值进行评估,截至评估基准日2020年12月31日,依漫生物的股东全部权益价值为人民币2,719.22万元。具体如下:
1)被评估单位:常州市依漫生物科技有限公司
2)评估基准日:2020年12月31日
3)评估目的:常州市久虹医疗器械有限公司拟转让常州市依漫生物科技有限公司股权。
4)评估对象及范围:评估对象为常州市依漫生物科技有限公司股东全部权益价值,评估范围为常州市依漫生物科技有限公司全部资产及全部负债。
5)评估方法及选取原因:本次选取资产基础法进行评估。
资产基础法的基本思路是按现行条件重建或重置被评估资产,潜在的投资者在决定投资某项资产时,所愿意支付的价格不会超过购建该项资产的现行购建成本。本评估项目能满足资产基础法评估所需的条件,即被评估资产处于继续使用状态或被假定处于继续使用状态,具备可利用的历史经营资料。采用资产基础法可以满足本次评估的价值类型的要求。
2-2-59
与此同时,被评估企业成立时间较短,目前仍处于建设期,未来年度的经营收益与风险在基准日时点尚难以可靠地估计,因此还不具备应用收益法评估的前提条件。且与被评估企业同一行业的国内上市公司,在产品类型、经营模式、企业规模、资产配置、未来成长性等方面具备可予比较的上市公司很少;同时近期产权交易市场类似行业特征、经营模式的股权交易较少,相关交易背景、交易案例的经营财务数据等信息无法从公开渠道获得,故不具备采用市场法评估的基本条件。6)评估结论:采用资产基础法对企业股东全部权益价值进行评估,得出被评估单位在评估基准日的评估结论:
评估基准日,被评估单位股东权益账面值2,663.69万元,评估值为2,719.22万元,增值率2.09%。其中:总资产账面值3,300.72万元,评估值3,356.26万元,增值率1.68%。负债账面值637.04万元,评估值637.04万元,增值率0.00 %。
评估结果汇总如下表:
单位:万元
| 序号 | 项目 | 账面价值 | 评估价值 | 增减值 | 增值率% |
| 1 | 流动资产 | 468.13 | 468.13 | 0.00 | 0.00 |
| 2 | 非流动资产 | 2,832.59 | 2,888.13 | 55.54 | 1.96 |
| 3 | 其中:可供出售金融资产 | 0.00 | 0.00 | 0.00 | 0.00 |
| 4 | 持有至到期投资 | 0.00 | 0.00 | 0.00 | 0.00 |
| 5 | 债权投资 | 0.00 | 0.00 | 0.00 | 0.00 |
| 6 | 其他债权投资 | 0.00 | 0.00 | 0.00 | 0.00 |
| 7 | 长期应收款 | 0.00 | 0.00 | 0.00 | 0.00 |
| 8 | 长期股权投资 | 0.00 | 0.00 | 0.00 | 0.00 |
| 9 | 其他权益工具投资 | 0.00 | 0.00 | 0.00 | 0.00 |
| 10 | 其他非流动金融资产 | 0.00 | 0.00 | 0.00 | 0.00 |
| 11 | 投资性房地产 | 0.00 | 0.00 | 0.00 | 0.00 |
| 12 | 固定资产 | 0.00 | 0.00 | 0.00 | 0.00 |
| 13 | 在建工程 | 997.01 | 1,016.20 | 19.19 | 1.92 |
| 14 | 生产性生物资产 | 0.00 | 0.00 | 0.00 | 0.00 |
2-2-60
| 序号 | 项目 | 账面价值 | 评估价值 | 增减值 | 增值率% |
| 15 | 油气资产 | 0.00 | 0.00 | 0.00 | 0.00 |
| 16 | 使用权资产 | 0.00 | 0.00 | 0.00 | 0.00 |
| 17 | 无形资产 | 1,247.74 | 1,284.09 | 36.35 | 2.91 |
| 18 | 开发支出 | 0.00 | 0.00 | 0.00 | 0.00 |
| 19 | 商誉 | 0.00 | 0.00 | 0.00 | 0.00 |
| 20 | 长期待摊费用 | 0.00 | 0.00 | 0.00 | 0.00 |
| 21 | 递延所得税资产 | 0.00 | 0.00 | 0.00 | 0.00 |
| 22 | 其他非流动资产 | 587.84 | 587.84 | 0.00 | 0.00 |
| 23 | 资产总计 | 3,300.72 | 3,356.26 | 55.54 | 1.68 |
| 24 | 流动负债 | 415.33 | 415.33 | 0.00 | 0.00 |
| 25 | 非流动负债 | 221.71 | 221.71 | 0.00 | 0.00 |
| 26 | 负债总计 | 637.04 | 637.04 | 0.00 | 0.00 |
| 27 | 净资产(所有者权益) | 2,663.69 | 2,719.22 | 55.54 | 2.09 |
上述评估结果的主要增减值变动分析如下:
①在建工程
在建工程账面值997.01万元,评估值1,016.20万元,增值19.19万元,主要系计算合理资金成本所致。
②无形资产
无形资产账面值1,247.74万元,评估值1,284.09万元,增值36.35万元,主要原因系近期土地价格略有上浮所致。
(3)依漫生物交易价格和价款支付情况
久虹医疗将其持有的依漫生物37.6%的股权以人民币1,033.50万元的价格转让给伊斯源,久虹医疗将其持有的依漫生物56.4%的股权以人民币1,550.25万元的价格转让给倍瑞诗。根据东洲评估出具的《常州市久虹医疗器械有限公司拟转让常州市依漫生物科技有限公司股权涉及的股东全部权益价值资产评估报告》(东洲评报字【2021】第0346号),截至评估基准日2020年12月31日,依漫生物的股东全部权益价值为人民币2,719.22万元,交易各方据此分别协商确定依漫生物股权转让价格。截至2021年3月24日和3月29日,倍瑞诗、伊斯源已分别向久虹医疗全额支付上述股权转让价款。
2-2-61
(4)上市公司暂不存在未来收购依漫生物的考虑或安排
依漫生物剥离后,其将保持独立运营,上市公司目前尚无对依漫生物的收购计划。
若后续拟对依漫生物进行收购,上市公司将会依照相关法律法规的规定以及上市公司规范运作的要求,履行相应的内外部决策审批程序与信息披露义务。
2、收购久虹医疗
唯德康医疗于2021年3月通过现金收购方式实现与久虹医疗同一控制下的内部重组。根据东洲评估出具的《常州市久虹医疗器械有限公司拟股权转让所涉及的股东全部权益价值资产评估报告》(东洲评报字【2021】第0388号),本次评估采用资产基础法对久虹医疗股东全部权益价值进行评估,确认以2020年12月31日为评估基准日,久虹医疗股东全部权益价值为人民币3,672.21万元。
(1)收购久虹医疗的必要性
1)久虹医疗及唯德康医疗母公司的产品类型
久虹医疗及唯德康医疗均从事消化内镜领域医疗器械研发、生产及销售,上述两个主体同时生产基础诊断类、止血闭合类、ESD类、ERCP类、泌尿骨科类和医用配件类产品,具体情况如下:
| 类别 | 代表性产品 | 是否拥有该类产品 | |
| 久虹医疗 | 唯德康医疗 | ||
| 基础诊断类 | 细胞刷、活体取样钳、异物钳、电圈套器、活检阀、清洁刷、压力泵、息肉收集器等 | 是 | 是 |
| 止血闭合类 | 止血夹 | 是 | 是 |
| ESD类 | 热活检钳、注射针等 | 是 | 是 |
| ERCP类 | 球囊扩张导管、取石网篮、取石球囊、异物钳、非血管腔道导丝等 | 是 | 是 |
| 泌尿骨科类 | 非血管腔道导丝 | 是 | 是 |
| 医用配件类 | 电圈套器配件、息肉切除器配件等 | 是 | 是 |
2)久虹医疗及唯德康医疗母公司下游客户情况
2-2-62
报告期内,久虹医疗及唯德康医疗母公司下游客户主要包括经销模式下的经销商及贴牌模式下境外贴牌客户,两者在报告期各期均存在向相同下游经销商及境外贴牌客户销售产品的情况。报告期各期合并口径前五大客户中唯德康医疗和久虹医疗的客户重叠情况如下表所示:
| 序号 | 客户名称 | 是否为唯德康医疗母公司和久虹医疗共同客户 |
| 1 | LIFE PARTNERS EUROPE及其关联公司 | 是 |
| 2 | PENTAX EUROPE GMBH | 是 |
| 3 | 杭州千生汇科技有限公司及其关联公司 | 是 |
| 4 | FUJIFILM MEDWORK GMBH | 是 |
| 5 | 杭州珠玑贸易商行 | 否 |
| 6 | 江苏舜天国际集团机械进出口有限公司及其关联公司 | 否 |
| 7 | MTW-ENDOSKOPIE W. HAAG KG | 是 |
| 8 | 河北迈得森医疗器械贸易有限公司 | 是 |
3)收购久虹医疗的必要性
2021年3月前,唯德康医疗与久虹医疗为同一实控人控制的两家主体,两者之间无直接的股权投资关系。为有效整合相关业务及资产,简化与上市公司重组交易安排,唯德康医疗于2021年3月通过现金收购方式实现与久虹医疗的内部重组。
唯德康医疗与久虹医疗作为同一类型产品的不同品牌,双方在业务发展层面既有协同也有竞争,为实现对收购标的经营主体和业务的完整整合,体现标的资产的整体价值,上述两个主体均纳入本次交易的收购资产范围,具体如下:
久虹医疗及唯德康医疗分别设立于2003年及2012年,自成立以来,久虹医疗及唯德康医疗均从事消化内镜领域医疗器械研发、生产及销售,产品类别基本一致,代表性产品较为相似,均为活检钳、圈套器、取石网篮、取石球囊导管、球囊扩张导管、斑马导丝等。唯德康医疗设立初衷系与久虹医疗进行差异化品牌定位,满足不同类型的客户需求,因此两者品牌定位有所不同,除此之外在产品类型、经营模式上均无显著差异。
在经营管理方面,久虹医疗及唯德康医疗实际控制人均为庄小金,亦由统
2-2-63
一的管理团队负责日常运营和管理,并在采购及销售方面均有一定重合,且在报告期内存在诸如委托加工等关联交易情况。从对收购标的经营主体和业务的整合角度来看,由上市公司对唯德康医疗和久虹医疗进行收购可以完整获得交易对方控制的消化内镜领域医疗器械业务,获得完整的品牌价值、人才优势及渠道优势,体现标的公司的整体价值。此外,收购久虹医疗能够避免交易对方在交易完成后与上市公司控制的唯德康医疗形成同业竞争,同时避免交易对方未来可能出现的利益倾斜等情况。因此,将久虹医疗及唯德康医疗均纳入上市公司本次收购范围具有必要性。在实际操作上,唯德康医疗于2021年3月通过现金收购方式先行与久虹医疗进行了内部重组。该次内部重组有利于简化交易结构,同时唯德康医疗在收购久虹医疗后能够形成更为统一的管理结构,便于上市公司日常管理和资源配置,降低上市公司管理成本。因此,该次内部重组具有必要性。
(2)本次交易中关于久虹医疗单体的评估情况
本次交易对唯德康医疗采用合并收益法进行评估,即以唯德康医疗合并口径财务报表为基础,对所有合并报表范围内的公司均进行单独预测后进行内部抵消,最终以合并报表形式进行收益法评估。
具体而言,本次交易对纳入合并报表范围的母公司唯德康医疗及其下属3家纳入合并范围内的长期股权投资单位按照法人主体单独进行了净利润预测,而后根据各个公司的预测中对内交易的销售与采购金额进行合并抵消,最终得到合并口径的预测数据。
为体现唯德康医疗的整体价值,本次对于合并报表范围内的唯德康母公司及其下属子公司均不进行单独的收益法估值计算,因此久虹医疗在本次收益法评估中无单独的评估结果。
本次评估选用唯德康医疗合并口径收益法对股权价值进行测算的主要原因如下:
1)母公司唯德康医疗及下属子公司存在较多的内部关联交易,包括关联销售及委托加工等,采用合并口径收益预测可以对内部关联交易进行合并抵消,
2-2-64
进而可以更好地反映母子公司在整体协同条件下的获利能力;2)母公司唯德康医疗及下属子公司均由统一的经营团队实施管理,企业所设的总经办、财务中心、营销中心、运营中心以及研发中心等部门在日常管理经营等方面存在较多重叠,考虑到相关管理团队在母子公司之间的精力分配可能无法进行明确的分摊,因此采用合并口径收益法进行预测更能体现企业的整体效应和价值;
3)母公司唯德康医疗及久虹医疗的主营业务均为消化内镜器械产品的销售,业务板块基本一致,合并口径收益法更能体现二者在整体上面临的市场竞争和风险。从而在折现率等参数的选择上更能体现企业整体效益、整体资本结构、整体面临各项风险因素的影响。基于上述考虑,本次在对唯德康医疗合并范围内子公司进行单独的净利润测算后,采用合并口径的现金流对收益法进行了测算。合并口径收益法中各核心数据测算口径如下:
| 序号 | 项目 | 单独测算/合并测算 |
| 1 | 合并范围内各公司净利润预测数据 | (1)各公司收入预测,按照各类产品销售收入预测合计进行预测,其中大类产品销售收入=销售数量*平均销售单价。鉴于标的公司产品大类均为消化内镜耗材领域产品,面对相同的行业政策和统一的经营策略,因此对销售数量的增长率预测及平均销售单价的变动率预测进行了合并考虑,在各主体之间选取了统一的增速预测 |
| (2)各公司的成本预测,按照各公司主体的历史经营状况及业务发展预期进行分别预测 | ||
| (3)各公司的费用预测,按照各公司主体的历史经营状况及业务发展预期进行分别预测 | ||
| (4)根据各个公司的预测中对内交易的销售与采购金额进行合并抵消,最终得到合并口径的预测数据 | ||
| 2 | 折旧摊销和资本性支出 | 单独测算 |
| 3 | 营运资金增加额 | 合并测算,根据内部关联抵消后的从合并口径营运资金状况预测情况确定未来预测期的营运资金增加额 |
| 4 | 企业自由现金流 | 合并测算,企业自由现金流=合并净利润+税后的付息债务利息+折旧摊销-资本性支出+营运资金增加额 |
| 5 | 折现率 | 合并测算,根据公司所处行业风险及公司特定风险,从整体效益、整体资本结构、整体面临的风险等口径选取适当的折现率 |
| 6 | 评估结论 | 合并测算 |
2-2-65
基于上述思路,本次并未对久虹医疗独立采用收益法计算得出子公司的收益法估值,而是作为唯德康医疗合并范围内的子公司统一在合并报表口径中进行了测算,但在唯德康医疗合并口径收益法估值中已包含了唯德康医疗母公司及久虹医疗及其他子公司的估值。
(3)本次交易中关于久虹医疗单体产品销售量、销售价格等增长率的预测依据与唯德康医疗母公司单体评估的可比性
本次收益法评估对于唯德康医疗合并范围内营业收入作为统一整体对其增长率进行了预测,其中包含唯德康医疗母公司单体及久虹医疗单体,主要原因如下:
1)唯德康医疗合并范围内,唯德康医疗母公司及久虹医疗均从事消化内镜器械产品的销售业务,业务板块基本一致,产品本身也具有同质性,同类产品在面对行业政策变化、市场环境变动及竞争格局等方面具备一致性;
2)唯德康医疗已于2021年3月通过现金收购方式实现与久虹医疗的内部重组,重组后唯德康医疗与久虹医疗在业务运营方面,如产品策略、销售推广活动等方面,并无显著差异;
3)唯德康医疗和久虹医疗在报告期各期均存在向相同下游经销商出售产品的情况,终端客户亦为同类客户。
基于上述,本次通过对唯德康医疗合并范围内主要产品类别的销量增长率和平均单价变动率进行整体预测后,分别以唯德康医疗母公司单体及久虹医疗单体历史年度经营业绩为基础进行预测,因此,唯德康医疗母公司单体及久虹医疗产品销售量及销售价格的增长率均保持一致,其主要产品类别的评估中预测参数对比情况如下:
| 项目 | 所属主体 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 | |
| 基础诊断类 | 销量增长率 | 唯德康医疗单体 | 40.00% | 40.00% | 35.00% | 25.00% | 15.00% |
| 久虹医疗单体 | 40.00% | 40.00% | 35.00% | 25.00% | 15.00% | ||
| 单价增长率 | 唯德康医疗单体 | - | -5.00% | -5.00% | -5.00% | -1.00% | |
| 久虹医疗单体 | - | -5.00% | -5.00% | -5.00% | -1.00% | ||
2-2-66
| 项目 | 所属主体 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 | |
| 止血闭合类收入 | 销量增长率 | 唯德康医疗单体 | 22.00% | 22.00% | 15.00% | 15.00% | 15.00% |
| 久虹医疗单体 | 22.00% | 22.00% | 15.00% | 15.00% | 15.00% | ||
| 单价增长率 | 唯德康医疗单体 | -5.00% | -5.00% | -5.00% | -1.00% | ||
| 久虹医疗单体 | -5.00% | -5.00% | -5.00% | -1.00% | |||
| ERCP类 | 销量增长率 | 唯德康医疗单体 | 45.00% | 40.00% | 32.00% | 15.00% | 10.00% |
| 久虹医疗单体 | 45.00% | 40.00% | 32.00% | 15.00% | 10.00% | ||
| 单价增长率 | 唯德康医疗单体 | - | -5.00% | -5.00% | -5.00% | -1.00% | |
| 久虹医疗单体 | - | -5.00% | -5.00% | -5.00% | -1.00% | ||
| ESD类 | 销量增长率 | 唯德康医疗单体 | 30.00% | 30.00% | 25.00% | 25.00% | 15.00% |
| 久虹医疗单体 | 30.00% | 30.00% | 25.00% | 25.00% | 15.00% | ||
| 单价增长率 | 唯德康医疗单体 | - | -5.00% | -5.00% | -5.00% | -1.00% | |
| 久虹医疗单体 | - | -5.00% | -5.00% | -5.00% | -1.00% | ||
3、本次重组评估与前述子公司最近三年评估的差异及原因
(1)前次现金收购久虹医疗与本次交易的作价差异
本次评估对唯德康医疗分别采用了资产基础法及收益法进行评估,并最终选取收益法作为评估结论。其中,收益法测算在考虑母公司唯德康医疗与子公司久虹医疗、锦福瑞医疗和图云医疗之间存在较多关联交易和内部协同的基础上,采用了唯德康医疗合并报表口径进行了收益预测,最终得到本次交易标的唯德康医疗100%股权价值,其中已包含各个子公司估值,故本次评估对久虹医疗未单独测算其股权价值,其价值和收益贡献已作为唯德康医疗有机整体的一部分得以反映,故无法单独测算久虹医疗前后两次的评估差异。
(2)前后两次采用不同评估方法的合理性
根据《常州市久虹医疗器械有限公司拟股权转让所涉及的股东全部权益价值资产评估报告》(编号:东洲评报字【2021】第0388号),前次现金收购久虹医疗的评估方法为资产基础法。本次交易久虹医疗作为唯德康医疗的全资子公司,在综合合并范围内各个公司主体经营情况的基础上,整体采用收益法评估并作为评估主结论,主要原因如下:
①两次评估目的及相应的评估范围不同
2-2-67
前次现金收购之评估目的系唯德康医疗完成内部股权重组,在前次现金收购久虹医疗的评估基准日时点,久虹医疗与唯德康医疗作为同一实际控制人下企业,但并无直接股权关系。在内部股权重组完成后久虹医疗成为唯德康医疗全资子公司。因此前次现金收购的评估范围仅包括久虹医疗的全部资产及负债,唯德康医疗母公司及其他子公司并不包含在内。本次交易评估系因唯德康医疗出让控股权,即奥赛康以发行股份及支付现金购买资产的形式收购唯德康医疗60%股权,评估范围为唯德康医疗的全部资产及负债,其中包含了经内部股权重组后作为子公司的久虹医疗的全部资产及负债。
②久虹医疗不具备单独进行收益法评估的前提条件
关于久虹医疗不具备单独进行收益法评估的前提条件参见重组报告书之“第四节 交易标的的基本情况”之“五、最近三年股权转让、增减资及资产评估或估值情况”之“(三)本次交易前收购久虹医疗的具体情况”之“2、本次交易中关于久虹医疗单体的评估情况”部分。
(3)本次交易增值情况
经评估,唯德康医疗股东全部权益于评估基准日2021年3月31日的市场价值为139,100.00万元,比合并口径经审计后账面归属于母公司股东权益19,585.38万元,增值119,514.62万元,增值率610.22%。比母公司单体经审计后账面股东权益19,383.90万元,增值119,716.10万元,增值率617.61%。久虹医疗作为唯德康医疗的全资子公司,其价值已体现在唯德康医疗整体评估值范围内。
本次收益法评估增值的原因系,唯德康医疗是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业。标的公司近年经营业绩稳步增长,凭借优质的产品质量和优秀的临床使用效果,标的公司已在内镜介入诊疗器械行业树立了较高的市场知名度和影响力。本次以被评估单位管理层提供的盈利预测为基础进行的收益法测算将企业视为一个有机整体,可以反映公司拥有的账面未反映的研发团队优势、服务能力优势和管理能力优势等重要的无形资源价值,因此采用收益法评估后标的公司股东权益评估价值较账面价值增值较大。
2-2-68
本次经评估后的唯德康医疗整体评估值与近期同行业可比收购案例在评估增值率方面具备可比性。具体情况如下:
从业务性质及本次交易的可比性角度,本次选取了2018年以来上市公司收购医疗器械企业的可比交易案例,考虑到:①可比交易案例的被收购标的在资产结构、会计政策等方面可能存在的差异,导致未入账的无形资产无法在账面净资产中得到充分辨识;②股东增资、分红等偶发因素对标的公司基准日溢余资产的影响;③可比交易的交易作价易受到交易双方议价能力的影响而无法有效呈现标的资产的市场客观公允价值。因此,为避免上述因素对市净率计算的影响,本次采用调整后增值率进行计算,具体公式如下:
修正后评估增值率=(交易标的100%股权评估值-基准日合并口径货币资金-基准日合并口径交易性金融资产)/(评估基准日交易标的100%股权资产基础法评估值-基准日合并口径货币资金-基准日合并口径交易性金融资产)-1
可比交易案例的评估结论相比账面净资产的增值率情况如下:
| 证券代码 | 证券简称 | 收购标的 | 评估基准日 | 修正后评估增值率 |
| 300341.SZ | 麦克奥迪 | 麦迪医疗80%股权 | 2017/12/31 | 757.60% |
| 603309.SH | 维力医疗 | 狼和医疗100%股权 | 2017/12/31 | 242.23% |
| 002082.SZ | 万邦德 | 康慈医疗80%股权 | 2018/5/31 | 584.20% |
| 300453.SZ | 三鑫医疗 | 宁波菲拉尔51%股权 | 2018/12/31 | 287.62% |
| 002382.SZ | 蓝帆医疗 | 武汉必凯尔100%股权 | 2019/6/30 | 388.93% |
| 600538.SH | 国发股份 | 高盛生物99.9779%股权 | 2019/12/31 | 519.90% |
| 可比交易平均值 | 463.41% | |||
| 可比交易中位数 | 454.42% | |||
| 002755.SZ | 奥赛康 | 唯德康医疗60%股权 | 2021/3/31 | 472.45% |
数据来源:Wind资讯、巨潮咨询网
注1:案例万邦德系采用收益法及市场法评估,本次以经审计账面归母净资产进行计算
注2:案例三鑫医疗因未披露基准日财务报表详细数据,本次不做调整
由上表可知,标的公司修正后评估增值率与行业可比交易案例的平均水平基本一致。
(4)本次交易评估基准日前向交易对方收购久虹医疗再置入上市公司,有
2-2-69
利于保护上市公司和中小股东权益唯德康医疗收购久虹医疗前,两者均从事内镜微创介入诊疗器械的研发、生产及销售,核心产品较为相似,同时两者在日常经营管理方面、销售实现方面及上游采购方面等均存在不同程度的重合。
为保证本次收购资产的完整性,实现对收购标的经营主体和业务的完整整合,体现标的公司的整体价值和管理协同,上市公司此次购买标的资产范围自双方接洽之初便包括唯德康医疗及久虹医疗两大主体。在交易评估基准日前,通过唯德康医疗现金收购久虹医疗进行内部重组的方式实现交易架构的简化,降低上市公司后续的管理成本,该收购行为有利于保护中小股东利益。
六、交易标的主要资产权属、对外担保及主要负债情况
(一)主要资产权属情况
1、固定资产情况
(1)房屋所有权情况
截至本报告书签署日,标的公司及其控股子公司共持有3项房屋所有权证,具体如下:
| 序号 | 权利人 | 产权证书编号 | 地址 | 用途 | 面积(㎡) | 他项权利 |
| 1 | 唯德康医疗 | 苏(2016)常州市不动产权第2021451号 | 常州市经发区果香路52号 | 生产 | 15,911.17 | 无 |
| 2 | 久虹 医疗 | 常房权证武字第01096393号 | 湖塘镇广电东路8号铂安国际商务楼7-A-1306 | 办公 | 167.26 | 无 |
| 3 | 久虹 医疗 | 常房权证武字第01096394号 | 湖塘镇广电东路8号铂安国际商务楼7-A-1305 | 办公 | 121.28 | 无 |
(2)土地使用权情况
截至本报告书签署日,标的公司及其控股子公司共持有3项土地使用权证,具体如下:
2-2-70
| 序号 | 权利人 | 产权证书 编号 | 地址 | 权利 类型 | 权利性质 | 面积(㎡) | 用途 | 使用期限 | 他项权利 |
| 1 | 唯德康医疗 | 苏(2016)常州市不动产权第2021451号 | 常州市经发区果香路52号 | 国有建设用地使用权 | 出让 | 11,333 | 工业 | 至2065.3.27 | 无 |
| 2 | 久虹 医疗 | 武国用(2010)第1210210-73号 | 湖塘镇广电东路8号铂安国际商务楼7-A-1305 | 国有建设用地使用权 | 出让 | 28.03 | 商业 | 至2043.06.15 | 无 |
| 3 | 久虹 医疗 | 武国用(2010)第1210210-74号 | 湖塘镇广电东路8号铂安国际商务楼7-A-1306 | 国有建设用地使用权 | 出让 | 38.65 | 商业 | 至2043.06.15 | 无 |
(3)租赁房产情况
截至本报告书签署日,标的公司及其控股子公司存在租赁房产的情况,具体如下:
| 序号 | 出租人 | 承租人 | 座落 | 面积 (m2) | 租赁期限 | 用途 |
| 1 | 都业梁、翟娇琴 | 唯德康医疗 | 南京市建邺区江东中路102号7楼701、711 | 317.42 | 2019.03.10 -2022.03.09 | 办公 |
| 2 | 石睿琦 | 唯德康医疗 | 上海市长宁区天山路600弄1号503室 | 155.99 | 2021.06.07- 2023.06.07 | 办公 |
| 3 | 常州金英汇商业管理有限公司 | 唯德康医疗 | 武进经济开发区兰香路18号 | 2间 | 2020.11.01- 2021.12.31 | 员工 宿舍 |
| 4 | 常州金英汇商业管理有限公司 | 唯德康医疗 | 武进经济开发区兰香路18号 | 1间 | 2020.11.12- 2021.12.31 | 员工 宿舍 |
| 5 | 常州金英汇商业管理有限公司 | 唯德康医疗 | 武进经济开发区兰香路18号 | 7间 | 2021.01.01- 2021.12.31 | 员工 宿舍 |
| 6 | 丁栋 | 唯德康医疗 | 常州市武进区樾华名苑20幢1402室 | 100.49 | 2021.04.20-2022.04.19 | 员工 宿舍 |
| 7 | 陈利建 | 唯德康医疗 | 常州市武进区樾华名苑18幢1404室 | 121.37 | 2021.05.10-2022.05.09 | 员工 宿舍 |
| 8 | 孙丽燕 | 唯德康医疗 | 常州市武进区新城公馆301幢甲单元1203室 | 125.29 | 2021.05.20-2022.05.19 | 员工 宿舍 |
| 9 | 常州市武进科创孵化园管理有限公司 | 久虹 医疗 | 常州市武进区湖塘镇鸣新中路256号武进科创园标准厂房编号为4A号 | 3,240 | 2018.01.15- 2029.10.31 | 生产 |
2-2-71
| 序号 | 出租人 | 承租人 | 座落 | 面积 (m2) | 租赁期限 | 用途 |
| 标准厂房第1-3层 | ||||||
| 10 | 常州市武进科创孵化园管理有限公司 | 久虹 医疗 | 常州市武进区湖塘镇鸣新中路256号武进科创园标准厂房编号为7A号标准厂房第1-3层 | 3,240 | 2018.08.08- 2029.10.31 | 生产 |
| 11 | 常州市滨湖生态城建设有限公司 | 锦福瑞医疗 | 常州市武进区西太湖科技产业园长杨路9号F1栋411室、412室、425室 | 82 | 2021.08.16-2026.08.16 | 办公 |
| 12 | 常州市滨湖生态城建设有限公司 | 图云 医疗 | 常州西太湖科技产业园兰香路8号石墨烯产业园9号楼四楼 | 2,056 | 2021.05.01- 2026.04.30 | 生产 |
| 13 | 江苏矽太信息科技有限公司 | 图云 医疗 | 无锡市新泰路8号江苏国际技术转移中心(中国无锡留学人员创业园B区)A楼1区5F、6F | 1,011 | 2021.03.01- 2024.04.30 | 研发及办公 |
(4)租赁土地情况
截至本报告书签署日,标的公司及其控股子公司存在租赁土地的情况,具体如下:
| 序号 | 租赁方 | 出租方 | 土地面积 | 用途 | 租期 | 年租金(万元) |
| 1 | 唯德康 医疗 | 常州市武进区雪堰镇潘家村民委员会 | 约20亩 | 后勤基地小 菜园 | 2021.01.01-2034.06.30 | 3 |
(5)主要生产设备情况
截至本报告书签署日,标的公司及其控股子公司主要生产机器设备包括激光焊接机、超声波焊机、铜套铆接机等。截至2021年6月30日,标的公司机器设备成新率为61.60%。
2、无形资产情况
(1)商标
截至本报告书签署日,标的公司及其控股子公司共拥有46项国内外商标,具体情况如下:
| 序号 | 商标 | 注册人 | 注册号 | 核定使用商品类别 | 有效期限 | 注册地 | 取得方式 |
2-2-72
| 序号 | 商标 | 注册人 | 注册号 | 核定使用商品类别 | 有效期限 | 注册地 | 取得方式 |
| 1 | 唯德康医疗 | 11509631 | 10 | 2014.02.21-2024.02.20 | 中国 | 继受取得 | |
| 2 | 唯德康医疗 | 11491067 | 10 | 2014.02.21-2024.02.20 | 中国 | 继受取得 | |
| 3 | 唯德康医疗 | 014341788 | 10 | 2015.07.09-2025.07.09 | 欧盟 | 原始取得 | |
| 4 | 唯德康医疗 | 303468655 | 10 | 2015.07.10-2025.07.09 | 香港 | 原始取得 | |
| 5 | 唯德康医疗 | 2015/19011 | 10 | 2015.07.15-2025.07.15 | 南非 | 原始取得 | |
| 6 | 唯德康医疗 | 1310755 | 10 | 2016.04.10-2026.04.10 | 美国(马德里注册) | 原始取得 | |
| 7 | 唯德康医疗 | 1310755 | 10 | 2016.04.10-2026.04.10 | 韩国(马德里注册) | 原始取得 | |
| 8 | 唯德康医疗 | 1310755 | 10 | 2016.04.10-2026.04.10 | 澳大利亚(马德里注册) | 原始取得 | |
| 9 | 唯德康医疗 | 1310755 | 10 | 2016.04.10-2026.04.10 | 土耳其(马德里注册) | 原始取得 | |
| 10 | 唯德康医疗 | 17676680 | 10 | 2016.10.07-2026.10.06 | 中国 | 原始取得 | |
| 11 | 唯德康医疗 | TMA958739 | 10 | 2016.12.22-2031.12.22 | 加拿大 | 原始取得 | |
| 12 | 唯德康医疗 | 016203481 | 10 | 2016.12.26-2026.12.26 | 欧盟 | 原始取得 | |
| 13 | 唯德康医疗 | 304003721 | 10 | 2016.12.27-2026.12.26 | 香港 | 原始取得 | |
| 14 | 唯德康医疗 | 17676632 | 10 | 2017.01.21-2027.01.20 | 中国 | 原始取得 | |
| 15 | 唯德康医疗 | 304083237 | 11 | 2017.03.21-2027.03.20 | 香港 | 原始取得 | |
| 16 | 唯德康医疗 | 909808724 | 10 | 2017.10.31-2027.10.31 | 巴西 | 原始取得 | |
| 17 | 唯德康医疗 | 23068179 | 35 | 2018.03.07-2028.03.06 | 中国 | 原始取得 | |
| 18 | 唯德康医疗 | 23068012 | 35 | 2018.03.07-2028.03.06 | 中国 | 原始取得 | |
| 19 | 唯德康医疗 | 30989896 | 10 | 2019.04.14-2029.04.13 | 中国 | 原始取得 | |
| 20 | 唯德康医疗 | 30988505 | 10 | 2019.04.21-2029.04.20 | 中国 | 原始取得 | |
| 21 | 唯德康医疗 | 30979637 | 10 | 2019.07.07-2029.07.06 | 中国 | 原始取得 | |
| 22 | 唯德康医疗 | 46665254 | 10 | 2021.04.07-2031.04.06 | 中国 | 原始取得 |
2-2-73
| 序号 | 商标 | 注册人 | 注册号 | 核定使用商品类别 | 有效期限 | 注册地 | 取得方式 |
| 23 | 唯德康医疗 | 46667988 | 10 | 2021.05.07-2031.05.06 | 中国 | 原始取得 | |
| 24 | 唯德康医疗 | 51831024 | 10 | 2021.08.14-2031.08.13 | 中国 | 原始取得 | |
| 25 | 唯德康医疗 | 51864370 | 10 | 2021.08.21-2031.08.20 | 中国 | 原始取得 | |
| 26 | 久虹医疗 | 10220291 | 10 | 2013.01.21-2023.01.20 | 中国 | 原始取得 | |
| 27 | 久虹医疗 | 11167999 | 10 | 2013.12.28-2023.12.27 | 中国 | 原始取得 | |
| 28 | 久虹医疗 | 11353497 | 10 | 2014.01.14-2024.01.13 | 中国 | 原始取得 | |
| 29 | 久虹医疗 | 11491076 | 10 | 2014.02.21-2024.02.20 | 中国 | 原始取得 | |
| 30 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 奥地利(马德里注册) | 原始取得 | |
| 31 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 比荷卢(马德里注册) | 原始取得 | |
| 32 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 瑞士(马德里注册) | 原始取得 | |
| 33 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 古巴(马德里注册) | 原始取得 | |
| 34 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 西班牙(马德里注册) | 原始取得 | |
| 35 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 法国(马德里注册) | 原始取得 | |
| 36 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 意大利(马德里注册) | 原始取得 | |
| 37 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 俄罗斯(马德里注册) | 原始取得 | |
| 38 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 捷克(马德里注册) | 原始取得 | |
| 39 | 久虹医疗 | 1291398 | 10 | 2016.01.29-2026.01.29 | 德国(马德里注册) | 原始取得 | |
| 40 | 久虹医疗 | 23067979 | 35 | 2018.05.14-2028.05.13 | 中国 | 原始取得 | |
| 41 | 久虹医疗 | 4821032 | 10 | 2008.10.14-2028.10.13 | 中国 | 继受取得 | |
| 42 | 久虹医疗 | 23068348 | 35 | 2018.10.14-2028.10.13 | 中国 | 原始取得 | |
| 43 | 久虹医疗 | 5350116 | 10 | 2009.05.07-2029.05.06 | 中国 | 继受取得 | |
| 44 | 久虹医疗 | 5286987 | 10 | 2009.07.28-2029.07.27 | 中国 | 继受取得 |
2-2-74
| 序号 | 商标 | 注册人 | 注册号 | 核定使用商品类别 | 有效期限 | 注册地 | 取得方式 |
| 45 | 久虹医疗 | 46656961 | 10 | 2021.01.21-2031.01.20 | 中国 | 原始取得 | |
| 46 | 久虹医疗 | 46647780 | 10 | 2021.01.28-2031.01.27 | 中国 | 原始取得 |
(2)专利
截至本报告书签署日,标的公司及其控股子公司共拥有142项专利,具体情况如下:
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 1 | 久虹医疗 | 带可视显影装置的球囊扩张导管 | 201120453107.3 | 实用新型 | 2011.11.16 | 2012.08.01 | 原始取得 |
| 2 | 久虹医疗 | 四连杆结构的止血夹 | 201220160369.5 | 实用新型 | 2012.04.16 | 2013.03.13 | 原始取得 |
| 3 | 久虹医疗 | 一种四连杆结构的止血夹 | 201210111139.4 | 发明 专利 | 2012.04.16 | 2014.04.09 | 原始取得 |
| 4 | 久虹医疗 | 一种新型的鼻胆引流管 | 201220632881.5 | 实用新型 | 2012.11.27 | 2013.07.10 | 继受取得 |
| 5 | 久虹医疗 | 一种具有分段硬度结构的鼻胆引流管 | 201220637771.8 | 实用新型 | 2012.11.27 | 2013.07.10 | 继受取得 |
| 6 | 久虹医疗 | 非血管腔道导丝 | 201320464540.6 | 实用新型 | 2013.07.31 | 2014.01.29 | 原始取得 |
| 7 | 久虹医疗 | 易旋转网型异物钳 | 201320511450.8 | 实用新型 | 2013.08.21 | 2014.02.19 | 原始取得 |
| 8 | 久虹医疗 | 易旋转圈套器 | 201320511596.2 | 实用新型 | 2013.08.21 | 2014.06.18 | 原始取得 |
| 9 | 久虹医疗 | 用于消化内镜上的活检阀 | 201320578924.0 | 实用新型 | 2013.09.18 | 2014.04.02 | 原始取得 |
| 10 | 久虹医疗 | 带刻度的包塑弹簧管取样钳 | 201420080211.6 | 实用新型 | 2014.02.25 | 2014.11.05 | 继受取得 |
| 11 | 久虹医疗 | 可测量的球囊扩张导管 | 201420310722.2 | 实用新型 | 2014.06.11 | 2014.11.26 | 原始取得 |
| 12 | 久虹医疗 | 可快速交换导丝的球囊扩张导管 | 201420311226.9 | 实用新型 | 2014.06.11 | 2014.11.26 | 原始取得 |
| 13 | 久虹医疗 | 带预埋导丝的球囊扩张导管 | 201420308996.8 | 实用新型 | 2014.06.11 | 2014.11.26 | 原始取得 |
2-2-75
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 14 | 久虹医疗 | 一种可避免碎石位移的取石网篮 | 201520185549.2 | 实用新型 | 2015.03.30 | 2015.08.12 | 原始取得 |
| 15 | 久虹医疗 | 可避免结石碎裂的取石网篮 | 201520186516.X | 实用新型 | 2015.03.30 | 2015.08.12 | 原始取得 |
| 16 | 久虹医疗 | 无导引式取石网篮 | 201520186325.3 | 实用新型 | 2015.03.30 | 2015.08.12 | 原始取得 |
| 17 | 久虹医疗 | 带导引头式取石网篮 | 201520186832.7 | 实用新型 | 2015.03.30 | 2015.08.12 | 原始取得 |
| 18 | 久虹医疗 | 一种医用注射针 | 201520206893.5 | 实用新型 | 2015.04.08 | 2015.08.12 | 原始取得 |
| 19 | 久虹医疗 | 一种低创伤医用注射针 | 201520208972.X | 实用新型 | 2015.04.08 | 2015.08.12 | 原始取得 |
| 20 | 久虹医疗 | 一种手术用高频电圈套器 | 201520219315.5 | 实用新型 | 2015.04.08 | 2015.08.12 | 原始取得 |
| 21 | 久虹医疗 | 一种一次性医用注射针 | 201520207554.9 | 实用新型 | 2015.04.08 | 2015.09.16 | 原始取得 |
| 22 | 久虹医疗 | 一种医用圈套器 | 201520206896.9 | 实用新型 | 2015.04.08 | 2015.08.12 | 原始取得 |
| 23 | 久虹医疗 | 一种大行程带网异物钳 | 201520224934.3 | 实用新型 | 2015.04.14 | 2015.8.26 | 原始取得 |
| 24 | 久虹医疗 | 一种带异物钳的圈套器 | 201520224496.0 | 实用新型 | 2015.04.14 | 2015.09.23 | 原始取得 |
| 25 | 久虹医疗 | 一种带注射针的可旋转圈套器 | 201520224932.4 | 实用新型 | 2015.04.14 | 2015.08.26 | 原始取得 |
| 26 | 久虹医疗 | 一种可旋转圈套器 | 201520224923.5 | 实用新型 | 2015.04.14 | 2015.08.26 | 原始取得 |
| 27 | 久虹医疗 | 一种可旋转网型异物钳 | 201520224864.1 | 实用新型 | 2015.04.14 | 2015.08.26 | 原始取得 |
| 28 | 久虹医疗 | 一种可旋转爪型异物钳 | 201520223673.3 | 实用新型 | 2015.04.14 | 2015.09.23 | 原始取得 |
| 29 | 久虹医疗 | 一种医用电圈套器 | 201520223672.9 | 实用新型 | 2015.04.14 | 2015.09.23 | 原始取得 |
| 30 | 久虹医疗 | 一种组合医疗器械 | 201520223643.2 | 实用新型 | 2015.04.14 | 2015.09.16 | 原始取得 |
| 31 | 久虹医疗 | 一种内窥镜用刷子 | 201520225479.9 | 实用新型 | 2015.04.14 | 2015.09.16 | 原始取得 |
| 32 | 久虹医疗 | 椎体扩张用球囊导管 | 201520232908.5 | 实用新型 | 2015.04.16 | 2015.08.26 | 原始取得 |
| 33 | 久虹医疗 | 椎体扩张用双球囊式导管 | 201520232065.9 | 实用新型 | 2015.04.16 | 2015.08.26 | 原始取得 |
| 34 | 久虹医疗 | 可自毁型球囊扩张导管 | 201520232567.1 | 实用新型 | 2015.04.16 | 2015.08.26 | 原始取得 |
2-2-76
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 35 | 久虹医疗 | 可单手推出型圈套器 | 201520232471.5 | 实用新型 | 2015.04.16 | 2015.08.26 | 原始取得 |
| 36 | 久虹医疗 | 具有新型端头结构的扩张条 | 201520242112.8 | 实用新型 | 2015.04.16 | 2015.08.26 | 原始取得 |
| 37 | 久虹医疗 | 可显影型扩张条 | 201520230408.8 | 实用新型 | 2015.04.16 | 2015.08.26 | 原始取得 |
| 38 | 久虹医疗 | 易推进型扩张条 | 201520232553.X | 实用新型 | 2015.04.16 | 2015.08.26 | 原始取得 |
| 39 | 久虹医疗 | 易于辨识型非血管腔道用导丝杆 | 201520237206.6 | 实用新型 | 2015.04.17 | 2015.08.26 | 原始取得 |
| 40 | 久虹医疗 | 具有显影环的非血管腔道用导丝杆 | 201520237169.9 | 实用新型 | 2015.04.17 | 2015.08.26 | 原始取得 |
| 41 | 久虹医疗 | 便于观察型导丝杆 | 201520237527.6 | 实用新型 | 2015.04.17 | 2015.08.26 | 原始取得 |
| 42 | 久虹医疗 | 内窥镜下可测量型取石球囊 | 201520235545.0 | 实用新型 | 2015.04.17 | 2015.08.26 | 原始取得 |
| 43 | 久虹医疗 | 可定位型取样器 | 201520237588.2 | 实用新型 | 2015.04.17 | 2015.08.26 | 原始取得 |
| 44 | 久虹医疗 | 配有导出圈的鼻胆引流管 | 201520237617.5 | 实用新型 | 2015.04.17 | 2015.08.26 | 原始取得 |
| 45 | 久虹医疗 | 细弯导丝 | 201620638350.5 | 实用新型 | 2016.06.24 | 2017.04.12 | 原始取得 |
| 46 | 久虹医疗 | 一体式取石网篮 | 201720811927.2 | 实用新型 | 2017.07.06 | 2019.02.26 | 原始取得 |
| 47 | 久虹医疗 | 新型取样钳 | 201721144750.1 | 实用新型 | 2017.09.08 | 2019.03.22 | 原始取得 |
| 48 | 久虹医疗 | 肺泡灌洗收集装置 | 201721191388.3 | 实用新型 | 2017.09.15 | 2019.04.26 | 原始取得 |
| 49 | 久虹医疗 | 可紧贴组织的圈套器 | 201820349702.4 | 实用新型 | 2018.03.15 | 2019.04.12 | 原始取得 |
| 50 | 久虹医疗 | 一种侧出的圈套器 | 201820349707.7 | 实用新型 | 2018.03.15 | 2019.05.14 | 原始取得 |
| 51 | 久虹医疗 | 过导丝胆道取样钳 | 201821575197.1 | 实用新型 | 2018.09.26 | 2019.09.17 | 原始取得 |
| 52 | 久虹医疗 | 可变篮丝数的取石网篮 | 201920957144.4 | 实用新型 | 2019.06.24 | 2020.05.26 | 原始取得 |
| 53 | 久虹医疗 | 非血管腔道导丝 | 201921989491.1 | 实用新型 | 2019.11.18 | 2020.07.28 | 原始取得 |
| 54 | 久虹医疗 | 可注水式黏膜切开刀 | 201921986490.1 | 实用新型 | 2019.11.18 | 2020.09.08 | 原始取得 |
| 55 | 久虹医疗 | 一种内镜注射针 | 201922377373.1 | 实用新型 | 2019.12.25 | 2020.09.15 | 原始取得 |
2-2-77
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 56 | 久虹医疗 | 一种手柄可分离式网篮 | 202020309662.8 | 实用新型 | 2020.03.13 | 2020.12.08 | 继受取得 |
| 57 | 久虹医疗 | 一种防卡顿网篮 | 202020309496.1 | 实用新型 | 2020.03.13 | 2020.12.08 | 继受取得 |
| 58 | 久虹医疗 | 一种手柄可分离式网篮 | 202020309622.3 | 实用新型 | 2020.03.13 | 2020.12.18 | 继受取得 |
| 59 | 霍春燕、久虹医疗 | 内镜预处理酶装置 | 202020656862.0 | 实用新型 | 2020.04.26 | 2020.12.11 | 原始取得 |
| 60 | 久虹医疗 | 亲水型弯头取石网篮 | 202020686191.2 | 实用新型 | 2020.04.29 | 2021.03.19 | 原始取得 |
| 61 | 久虹医疗 | 喷洒注射针 | 202020747971.3 | 实用新型 | 2020.05.07 | 2021.03.19 | 原始取得 |
| 62 | 久虹医疗 | 可三级扩张的显影球囊 | 202020793665.3 | 实用新型 | 2020.05.13 | 2021.04.20 | 原始取得 |
| 63 | 久虹医疗 | 三级扩张球囊导管 | 202020793663.4 | 实用新型 | 2020.05.13 | 2021.05.07 | 原始取得 |
| 64 | 久虹医疗 | 可清洁创面的止血夹 | 202020804855.0 | 实用新型 | 2020.05.14 | 2021.05.07 | 原始取得 |
| 65 | 久虹医疗 | 记忆弯头可旋转细胞刷 | 202020806594.6 | 实用新型 | 2020.05.14 | 2021.05.07 | 原始取得 |
| 66 | 久虹医疗 | 一种新型亲水涂层导丝 | 202020820775.4 | 实用新型 | 2020.05.15 | 2021.05.14 | 原始取得 |
| 67 | 久虹医疗 | 可控旋转黏膜切开刀 | 202020857132.7 | 实用新型 | 2020.05.20 | 2021.01.01 | 原始取得 |
| 68 | 刘晓岗、久虹医疗 | 可伸缩头部可张开型透明帽 | 202020859785.9 | 实用新型 | 2020.05.20 | 2021.05.07 | 原始取得 |
| 69 | 久虹医疗 | 一种取石网篮 | 202021344486.8 | 实用新型 | 2020.07.09 | 2021.06.01 | 原始取得 |
| 70 | 久虹医疗 | 带安全光栅的外科口罩生产设备 | 202022150216.X | 实用新型 | 2020.09.25 | 2021.05.14 | 原始取得 |
| 71 | 久虹医疗 | 外科口罩耳带对折热压成型设备 | 202022159714.0 | 实用新型 | 2020.09.27 | 2021.07.06 | 原始取得 |
| 72 | 久虹医疗 | 口罩机打料计数装置 | 202022265377.3 | 实用新型 | 2020.10.12 | 2021.07.06 | 原始取得 |
| 73 | 久虹医疗 | 外科口罩生产设备的鼻梁条状态监测与校直装置 | 202022161478.6 | 实用新型 | 2020.09.27 | 2021.08.06 | 原始取得 |
| 74 | 唯德康医疗 | 一种不易脱头的医用导丝 | 201320146954.4 | 实用新型 | 2013.03.28 | 2013.09.25 | 原始取得 |
| 75 | 唯德康医疗 | 防污染细胞刷 | 201420152339.9 | 实用新型 | 2014.04.01 | 2014.09.03 | 继受取得 |
2-2-78
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 76 | 唯德康医疗 | 止血夹 | 201420174360.9 | 实用新型 | 2014.04.11 | 2014.09.03 | 原始取得 |
| 77 | 唯德康医疗 | 缝合线锁紧装置 | 201420315942.4 | 实用新型 | 2014.06.13 | 2014.11.05 | 原始取得 |
| 78 | 唯德康医疗 | 组织穿孔缝合器及其使用方法 | 201410265359.1 | 发明 专利 | 2014.06.13 | 2016.01.27 | 原始取得 |
| 79 | 唯德康医疗 | 覆膜带网异物钳 | 201420382053.X | 实用新型 | 2014.07.10 | 2014.12.03 | 继受取得 |
| 80 | 唯德康医疗 | 双封堵防污染细胞刷 | 201420391664.0 | 实用新型 | 2014.07.15 | 2014.12.03 | 原始取得 |
| 81 | 唯德康医疗 | 轴向剪线装置 | 201420396611.8 | 实用新型 | 2014.07.17 | 2014.12.17 | 原始取得 |
| 82 | 唯德康医疗 | 一种防反流塑料胆道支架 | 201420667129.3 | 实用新型 | 2014.11.10 | 2015.03.11 | 继受取得 |
| 83 | 唯德康医疗 | 黏膜切开刀 | 201520044033.6 | 实用新型 | 2015.01.22 | 2015.07.08 | 原始取得 |
| 84 | 唯德康医疗 | 夹片式重复开合止血夹 | 201520317758.8 | 实用新型 | 2015.05.15 | 2015.09.30 | 原始取得 |
| 85 | 唯德康医疗 | 头端可隐藏的扩张器械 | 201620285748.5 | 实用新型 | 2016.04.07 | 2017.02.22 | 原始取得 |
| 86 | 唯德康医疗 | 支架释放器 | 201620553217.X | 实用新型 | 2016.06.08 | 2016.12.28 | 原始取得 |
| 87 | 唯德康医疗 | 活检钳鞘管 | 201621382924.3 | 实用新型 | 2016.12.15 | 2018.01.05 | 原始取得 |
| 88 | 唯德康医疗 | 胆道引流导管 | 201720137255.1 | 实用新型 | 2017.02.15 | 2018.02.13 | 原始取得 |
| 89 | 唯德康医疗 | 防爆取石球囊导管 | 201720137273.X | 实用新型 | 2017.02.15 | 2018.02.13 | 原始取得 |
| 90 | 唯德康医疗 | 取石网篮 | 201720137275.9 | 实用新型 | 2017.02.15 | 2018.02.13 | 原始取得 |
| 91 | 唯德康医疗 | 一次性使用电圈套器 | 201720137252.8 | 实用新型 | 2017.02.15 | 2018.02.13 | 原始取得 |
| 92 | 唯德康医疗 | 球囊扩张导管 | 201720137238.8 | 实用新型 | 2017.02.15 | 2018.04.03 | 原始取得 |
| 93 | 唯德康医疗 | 内镜用注射针 | 201720253389.X | 实用新型 | 2017.03.15 | 2018.04.03 | 原始取得 |
| 94 | 唯德康医疗 | 内窥镜用给药管 | 201720250189.9 | 实用新型 | 2017.03.15 | 2018.04.03 | 原始取得 |
| 95 | 唯德康医疗 | 取石网器械 | 201720253992.8 | 实用新型 | 2017.03.16 | 2018.07.06 | 原始取得 |
| 96 | 唯德康医疗 | 组织穿孔缝合器 | 201720253802.2 | 实用新型 | 2017.03.16 | 2018.07.06 | 原始取得 |
| 97 | 唯德康医疗 | 封堵器 | 201820024197.6 | 实用新型 | 2018.01.05 | 2019.02.19 | 原始取得 |
| 98 | 唯德康医疗 | 一种内镜下 | 201820022702.3 | 实用 | 2018.01.05 | 2019.08.09 | 继受 |
2-2-79
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 治疗用磁珠 | 新型 | 取得 | |||||
| 99 | 唯德康医疗 | 支架或导管体内疏通装置 | 201820065605.2 | 实用新型 | 2018.01.15 | 2019.07.12 | 继受取得 |
| 100 | 唯德康医疗 | 内窥镜下使用的手术夹 | 201820088006.2 | 实用新型 | 2018.01.18 | 2019.03.08 | 继受取得 |
| 101 | 唯德康医疗 | 一种转换接头 | 201820442520.1 | 实用新型 | 2018.03.30 | 2019.06.11 | 原始取得 |
| 102 | 唯德康医疗 | 手持式止血夹 | 201820821518.5 | 实用新型 | 2018.05.29 | 2019.05.14 | 原始取得 |
| 103 | 唯德康医疗 | 止血夹及组织穿孔缝合器械 | 201820813460.X | 实用新型 | 2018.05.29 | 2019.05.31 | 原始取得 |
| 104 | 唯德康医疗 | 可固定于非血管腔道内的导丝 | 201820871455.4 | 实用新型 | 2018.05.29 | 2019.07.09 | 原始取得 |
| 105 | 唯德康医疗 | 可用于异物取出的内镜下扩张球囊 | 201821042209.4 | 实用新型 | 2018.06.29 | 2019.05.31 | 继受取得 |
| 106 | 唯德康医疗 | 用于止血夹的手柄组件 | 201821219501.9 | 实用新型 | 2018.07.30 | 2019.06.25 | 原始取得 |
| 107 | 唯德康医疗 | 内窥镜用胆道超选导管 | 201821345513.6 | 实用新型 | 2018.08.20 | 2020.01.14 | 继受取得 |
| 108 | 唯德康医疗 | 柔性可回收穿刺锚及其固定器 | 201821530652.6 | 实用新型 | 2018.09.13 | 2019.07.19 | 原始取得 |
| 109 | 唯德康医疗 | 头部可弯曲的球囊扩张导管 | 201821598808.4 | 实用新型 | 2018.09.26 | 2019.07.23 | 原始取得 |
| 110 | 唯德康医疗 | 弯头网篮 | 201821595842.6 | 实用新型 | 2018.09.28 | 2019.07.23 | 原始取得 |
| 111 | 唯德康医疗 | 一种带锁紧结构的可旋转圈套器 | 201920517174.3 | 实用新型 | 2019.04.16 | 2020.04.07 | 原始取得 |
| 112 | 胡晓、唯德康医疗 | 可脱落式球囊 | 201920689178.X | 实用新型 | 2019.05.14 | 2020.04.07 | 原始取得 |
| 113 | 唯德康医疗 | 内镜下药粉喷洒管 | 201920890424.8 | 实用新型 | 2019.06.13 | 2020.05.26 | 原始取得 |
| 114 | 唯德康医疗 | 过导丝预弯网篮 | 201920965972.2 | 实用新型 | 2019.06.25 | 2020.05.26 | 继受取得 |
| 115 | 唯德康医疗 | 夹闭钩 | 201921270664.4 | 实用新型 | 2019.08.07 | 2020.07.28 | 原始取得 |
| 116 | 唯德康医疗 | 一种内镜用清洗管 | 201921550398.0 | 实用新型 | 2019.09.18 | 2020.08.18 | 原始取得 |
| 117 | 胡晓、唯德康医疗 | 内镜延长管 | 201921680895.2 | 实用新型 | 2019.10.09 | 2020.07.17 | 原始取得 |
2-2-80
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 118 | 唯德康医疗 | 内镜下食管胃底静脉曲张硬化剂注射用透明帽 | 201921728621.6 | 实用新型 | 2019.10.15 | 2020.07.28 | 继受取得 |
| 119 | 唯德康医疗 | 柔性扩张用透明帽 | 201921740735.2 | 实用新型 | 2019.10.17 | 2020.10.16 | 继受取得 |
| 120 | 唯德康医疗 | 医用牵拉器 | 201921887656.4 | 实用新型 | 2019.11.05 | 2020.08.25 | 原始取得 |
| 121 | 唯德康医疗 | 组织拉钩及具有该组织拉钩的医用牵拉器 | 201921887702.0 | 实用新型 | 2019.11.05 | 2020.08.25 | 原始取得 |
| 122 | 唯德康医疗 | 组织拉钩及具有该组织拉钩的医用牵拉器 | 201921886867.6 | 实用新型 | 2019.11.05 | 2020.08.28 | 原始取得 |
| 123 | 胡晓、唯德康医疗 | 可脱落牵拉透明帽 | 201922033825.4 | 实用新型 | 2019.11.22 | 2020.08.18 | 原始取得 |
| 124 | 刘晓岗、唯德康医疗 | 内镜下病变测量器 | 201922276229.9 | 实用新型 | 2019.12.17 | 2020.10.23 | 原始取得 |
| 125 | 唯德康医疗、胡晓 | 可调节型圈套器 | 201922389932.0 | 实用新型 | 2019.12.26 | 2020.10.13 | 原始取得 |
| 126 | 唯德康医疗 | 用于食道异物取出的透明帽 | 201922423052.0 | 实用新型 | 2019.12.27 | 2020.10.13 | 继受取得 |
| 127 | 唯德康医疗 | 一种支架编织方法及使用该方法制成的支架 | 202010025739.3 | 发明 专利 | 2020.01.10 | 2021.06.01 | 原始取得 |
| 128 | 唯德康医疗 | 支架植入器驱动机构及医疗支架置入器 | 202020308103.5 | 实用新型 | 2020.03.13 | 2020.12.01 | 原始取得 |
| 129 | 唯德康医疗 | 一种吻合夹和包含所述吻合夹的吻合套装 | 202020333322.9 | 实用新型 | 2020.03.17 | 2020.12.08 | 原始取得 |
| 130 | 唯德康医疗 | 支架植入器驱动机构及医疗支架植入装置 | 202020369352.5 | 实用新型 | 2020.03.20 | 2021.02.02 | 原始取得 |
| 131 | 唯德康医疗 | 一种医用内窥镜装置 | 202020776534.4 | 实用新型 | 2020.05.12 | 2021.02.02 | 原始取得 |
| 132 | 唯德康医疗 | 一种应用于内窥镜的传动结构和内窥镜手柄 | 202020861475.0 | 实用新型 | 2020.05.21 | 2021.07.06 | 原始取得 |
2-2-81
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权 公告日 | 取得方式 |
| 133 | 刘晓岗、唯德康医疗 | 球囊型金属支架 | 202020911532.1 | 实用新型 | 2020.05.26 | 2021.05.07 | 原始取得 |
| 134 | 唯德康医疗 | 内窥镜操作手柄 | 202021433818.X | 实用新型 | 2020.07.20 | 2021.01.15 | 原始取得 |
| 135 | 唯德康医疗 | 一种吻合夹套装及其内窥镜装置 | 202021427335.9 | 实用新型 | 2020.07.20 | 2021.06.01 | 原始取得 |
| 136 | 唯德康医疗 | 一种吻合夹 | 202021434922.0 | 实用新型 | 2020.07.20 | 2021.06.22 | 原始取得 |
| 137 | 唯德康医疗 | 一种ESD手术牵引器械 | 202021662162.9 | 实用新型 | 2020.08.12 | 2021.02.02 | 原始取得 |
| 138 | 唯德康医疗 | 一种吻合夹套装 | 202022531908.9 | 实用新型 | 2020.11.05 | 2021.07.06 | 原始取得 |
| 139 | 唯德康医疗 | 一种吻合夹套装 | 202022532216.6 | 实用新型 | 2020.11.05 | 2021.07.06 | 原始取得 |
| 140 | 唯德康医疗 | 一种内窥镜用透明帽 | 202022532228.9 | 实用新型 | 2020.11.05 | 2021.07.06 | 原始取得 |
| 141 | 唯德康医疗 | 一种吻合夹套装 | 202022533840.8 | 实用新型 | 2020.11.05 | 2021.07.06 | 原始取得 |
| 142 | 唯德康医疗 | 一种内窥镜操作手柄 | 202022773375.5 | 实用新型 | 2020.11.26 | 2021.09.17 | 原始取得 |
(3)共有专利情形
①共有专利背景及具体内容
标的公司在消化内镜介入诊疗器械领域深耕多年,深知临床需求及应用是标的公司诊疗器械产品发展创新过程中的核心驱动力。因此,标的公司始终以满足临床应用为导向,以临床需求驱动创新,在坚持自主研发的同时,积极开展“医工结合”的模式,通过与医疗机构/及医疗工作者的广泛交流、密切合作,不断推出符合临床需求的创新性产品。
原披露的13项共有专利中,12项专利系标的公司与临床医生共同拥有,1项专利系标的公司与其总工程师缪东林共同拥有。
标的公司与临床医生共有专利的主要原因为:在“医工结合”过程中,标的公司根据临床医生反馈的临床痛点和需求,结合创新难度、技术可行性、临床需求稳定性和临床适应性等因素,开展原理验证、自主设计开发、产品样机的生产和检测、临床试验等一系列研发活动,研发过程中随时与临床医生沟通交流,对研发设计进行改进、完善,打造出更适合临床使用的产品。由于研发过程中临床医生发挥了一定作用,因此,由标的公司和临床医生共同作为专利
2-2-82
权人。标的公司与其总工程师共有专利的主要原因为:在唯德康医疗成立初期,标的公司管理层曾尝试将唯德康医疗和核心技术人员共同注册为专利权人的方式,以鼓励员工技术创新。缪东林作为总工程师在唯德康医疗成立初期的技术研发过程中贡献突出,因此,管理层于2014年将唯德康医疗和缪东林共同作为实用新型专利“覆膜带网异物钳”(专利号:201420382053.X)的专利权人。后基于市场等因素综合考量,标的公司此后未对该专利进一步研发并转化为产品。目前,缪东林已无偿将其在该专利中享有的权利转让给唯德康医疗,唯德康医疗已变更为该专利的唯一专利权人。截至本报告签署日,标的公司原披露的13项共有专利及进度如下:
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权公告日 |
| 1 | 唯德康医疗 | 防污染细胞刷 | 201420152339.9 | 实用新型 | 2014.04.01 | 2014.09.03 |
| 2 | 唯德康医疗 | 覆膜带网异物钳 | 201420382053.X | 实用新型 | 2014.07.10 | 2014.12.03 |
| 3 | 孙昊 | 导丝切开刀 | 201820831020.7 | 实用新型 | 2018.05.30 | 2019.05.07 |
| 4 | 李宇 | 胆道镜下可脱落式新型引流管 | 201821645819.3 | 实用新型 | 2018.10.10 | 2019.09.17 |
| 5 | 胡晓、唯德康医疗 | 可脱落式球囊 | 201920689178.X | 实用新型 | 2019.05.14 | 2020.04.07 |
| 6 | 胡晓、唯德康医疗 | 内镜延长管 | 201921680895.2 | 实用新型 | 2019.10.09 | 2020.07.17 |
| 7 | 胡晓、唯德康医疗 | 可脱落牵拉透明帽 | 201922033825.4 | 实用新型 | 2019.11.22 | 2020.08.18 |
| 8 | 刘晓岗、唯德康医疗 | 内镜下病变测量器 | 201922276229.9 | 实用新型 | 2019.12.17 | 2020.10.23 |
| 9 | 唯德康医疗、胡晓 | 可调节型圈套器 | 201922389932.0 | 实用新型 | 2019.12.26 | 2020.10.13 |
| 10 | 霍春燕、久虹医疗 | 内镜预处理酶装置 | 202020656862.0 | 实用新型 | 2020.04.26 | 2020.12.11 |
| 11 | 刘晓岗、久虹医疗 | 可伸缩头部可张开型透明帽 | 202020859785.9 | 实用新型 | 2020.05.20 | 2021.05.07 |
| 12 | 刘晓岗、唯德康 | 球囊型金属支架 | 202020911532.1 | 实用新型 | 2020.05.26 | 2021.05.07 |
| 13 | 姚俊 | 半段膜金属支架 | 202021344488.7 | 实用 | 2020.07.09 | 2021.05.0 |
2-2-83
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权公告日 |
| 新型 | 7 |
注1:上表第1、2项专利,已分别于2021年9月26日、9月22日变更为标的公司单独所有;上表第3、4、13项专利,已分别于2021年8月6日、2021年8月2日、2021年9月28日变更为原共有方孙昊、李宇、姚俊单独所有。
注2:上表第7项专利,正在办理专利转入手续。
注3:上表第10项专利,共有双方经商议计划放弃该专利权,因此,2021年4月未续缴专利年费,预计该专利权将于2021年10月自动终止。
注4:上表第5、6、8、9、11、12项专利,正在进行专利转让程序,转让完成后标的公司将不再拥有该等专利的专利权。
如上表所述,截至本报告书签署日,该等13项专利中尚有8项专利处于共有状态,后续该共有状态将全部终止。
上述专利共有期间,除共有双方就“可脱落牵拉透明帽”的权利行使进行了书面约定:“未经双方书面同意,任何一方不得独自或与第三方利用或使用上述知识产权,双方无权许可第三方使用知识产权。”以外,其他12项专利的共有人未签署关于共有专利权权利行使的书面文件。
根据上述13项专利共有人出具的声明函,该等专利共有人从未使用且从未对外授权任何第三方使用上述13项专利。对于上述13项专利中正在办理专利转出手续的专利及共有双方计划放弃专利权的专利,其共有人在其出具的声明函中进一步声明,在专利共有期间,专利共有人将不会使用且将不会对外授权任何第三方使用该等专利。因此,标的公司共有专利于共有期间未授权第三方使用专利权。
收益分配方面,截至本报告书签署日,标的公司仅就“可脱落牵拉透明帽”该项专利正在进行产业化,但尚未实现销售。其余12项专利尚未实施产业化。截至本报告书签署日,标的公司与专利共有人未签署基于专利的收益分配约定。
②共有专利对标的公司生产经营的影响
标的公司主要从事内镜介入诊疗器械的研发、生产和销售业务,主要产品应用于消化内镜诊疗领域,可进一步分为基础诊断类、止血闭合类、ESD类、ERCP类等,与消化内镜配套用于消化道疾病的临床诊断与治疗。上述13项专利系在标的公司已有产品层面的功能创新或改造。
截至本报告书签署日出具日,原披露的13项共有专利中,除“可脱落牵拉
2-2-84
透明帽”外,其余12项共有专利均未实现产品转化/商业转化且暂不存在产品转化/商业转化计划。因此,13项共有专利对标的公司生产经营尚未产生收入实现或利润贡献。鉴于上述专利所载技术主要为标的公司现有产品的功能性改进,以提高部分临床情景下的产品易用性,并非标的公司的必备核心技术。标的公司亦可通过其他工艺结构设计达到上述专利技术所提供的功能性改进的目标,因此对标的公司生产经营影响有限。对于标的公司与第三方共有的专利,由于本次交易涉及的标的资产为唯德康医疗的60%股权,专利证书上载明的共有专利权人不会因本次交易而发生变更,共有专利的共有双方均未签署关于共有权人股东变更需取得其他共有权人同意的书面文件。因此,本次交易无须取得专利共有权人的同意。
(4)域名
截至本报告书签署日,标的公司及其控股子公司共拥有2项域名,具体情况如下:
| 序号 | 持有者 | 域名 | 域名所属注册机构 | 域名注册 日期 | 域名到期 日期 |
| 1 | 唯德康医疗 | vedkang.com | 北京新网数码信息科技有限公司 | 2012.09.19 | 2025.09.19 |
| 2 | 久虹 医疗 | jiuhongmed.com | Alibaba Cloud Computing (Beijing) Co., Ltd(阿里巴巴云计算(北京)有限公司) | 2006.03.09 | 2024.03.09 |
(二)对外担保、主要负债及或有负债情况
1、主要负债情况
报告期内,唯德康医疗的主要负债情况如下:
单位:万元
| 项目 | 2021年6月30日 | 2020年12月31日 | 2019年12月31日 |
| 流动负债: | |||
| 应付账款 | 3,334.88 | 2,641.37 | 2,595.63 |
| 预收款项 | - | - | 1,176.38 |
| 合同负债 | 1,154.35 | 697.96 | - |
2-2-85
| 项目 | 2021年6月30日 | 2020年12月31日 | 2019年12月31日 |
| 应付职工薪酬 | 1,457.36 | 1,794.64 | 1,953.59 |
| 应交税费 | 577.39 | 351.82 | 854.16 |
| 其他应付款 | 1,917.08 | 16,054.78 | 2,113.35 |
| 一年内到期的非流动负债 | 141.05 | - | - |
| 其他流动负债 | 44.52 | 25.28 | - |
| 流动负债合计 | 8,626.62 | 21,565.86 | 8,693.10 |
| 非流动负债: | |||
| 租赁负债 | 586.03 | - | - |
| 递延收益 | - | 221.71 | - |
| 递延所得税负债 | 46.62 | 49.45 | - |
| 非流动负债合计 | 632.65 | 271.16 | - |
| 负债合计 | 9,259.27 | 21,837.01 | 8,693.10 |
2、对外担保及或有负债情况
截至本报告书签署日,标的公司及其子公司产权清晰,不存在抵押、质押等权利限制,也不存在对外担保以及其他对未来经营活动具有重大影响的或有负债。
(三)是否涉及处罚、诉讼、仲裁、司法强制执行等重大争议的情况说明
截至本报告书签署日,标的公司及其子公司不存在因涉嫌犯罪被司法机关立案侦查或者涉嫌违法违规被中国证监会立案调查的情形,未曾受到相关行政处罚或者刑事处罚;也不存在尚未完结的重大诉讼、仲裁、司法强制执行等重大争议或者其他妨碍权属转移的其他情况。
报告期内,标的公司严格遵守《中华人民共和国反不正当竞争法》《国家工商行政管理局关于禁止商业贿赂行为的暂行规定》等相关法律法规的规定,未有不正当竞争或商业贿赂等违法违规行为。
标的公司制定了《现金管理制度》《出差管理制度》《财务报销管理制度》《报销凭证附件说明》等制度防范内部员工不正当竞争和商业贿赂等违法违规情形的发生,建立了公司反商业贿赂的长效预警机制,对全体员工相关行为准则进行了规范,明令禁止利用职权和职务上的便利谋取不正当的利益或损害公
2-2-86
司利益;同时,标的公司在日常员工培训中要求全体员工必须认真学习并深刻理解反不正当竞争和商业贿赂有关法律法规,在公司战略制定、决策执行及日常运行中自觉抵制不正当竞争和商业贿赂行为。标的公司在与经销商签订《经销合同》时明确规定反商业贿赂条款,并要求经销商签订《廉洁承诺书》,对经销商的不正当竞争和商业贿赂行为进行了约束。报告期内,标的公司在业务经营过程中不存在不正当竞争、商业贿赂等违法违规行为,标的公司及其董事、监事、高级管理人员不存在因不正当竞争、商业贿赂而受到行政处罚或诉讼的情况。
七、标的公司主营业务情况
(一)主营业务概况
唯德康医疗是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业,旗下拥有“久虹”和“唯德康”两个品牌系列产品,围绕消化内镜诊疗领域进行了系统性的产品布局,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求。目前已上市销售的产品可进一步分为基础诊断类、止血闭合类、ESD类、ERCP类等,与消化内镜配套用于消化道疾病的临床诊断与治疗,具体包括细胞刷、取样钳、圈套器、注射针、止血夹、取石网篮、取石球囊导管、非血管腔道导丝、ESD电刀等20余大类消化内镜器械。
作为高新技术企业,标的公司始终坚持研发自主创新,积极配合临床医生的使用需求,解决临床手术困惑,研发了“鲲鹏刀”等系列的创新产品。截至本报告书签署日,唯德康医疗已取得共计142项专利,其中发明专利3项,实用新型专利139项,并已取得国内产品注册及备案证书共计47项,其中三类医疗器械产品注册证书9项,二类医疗器械产品注册证书34项,一类医疗器械产品备案4项,相关核心产品已获得欧盟CE、美国FDA、ISO13485等国内外权威认证。
标的公司深耕消化内镜医疗器械领域,顺应行业发展趋势,充分把握国产高端产品进口替代的历史机遇,曾被评定为国家级“示范医疗器械企业”、“江
2-2-87
苏省内镜下诊断医疗器械工程技术研究中心”、“江苏省著名商标”等。凭借优质的产品质量和优秀的临床使用效果,标的公司已在内镜诊疗器械行业树立了较高的市场知名度和品牌影响力。
(二)主要产品的用途及变化情况
报告期内,唯德康医疗主要以销售消化内镜器械产品为主,按照应用场景的不同,唯德康医疗主要产品可进一步分为基础诊断类、止血闭合类、ESD类、ERCP类等四大类,标的公司主要产品情况如下:
| 类别 | 细分产品 | 图例 | 用途 |
| 基础诊断类 | 一次性使用细胞刷 | 用于获取细胞组织样本 | |
| 一次性使用活体取样钳 | 用于收集病理标本 | ||
| 食道扩张器 | 用于食道扩张 | ||
| 异物钳 | 用于取出较大障碍物 | ||
| 一次性使用电圈套器 | 用于圈套息肉以切除 | ||
| 止血闭合类 | 一次性使用止血夹 | 用于夹合消化道内软组织并止血 | |
| ESD类 | 一次性使用热活检钳 | 配合高频电流可电烧、凝固、止血或采集组织 | |
| 一次性内镜用注射针 | 用于消化道黏膜下注射 |
2-2-88
| 类别 | 细分产品 | 图例 | 用途 |
| 一次性使用黏膜切开刀 | 用于切开消化道内组织 | ||
| 一次性使用内窥镜给药管 | 用于对人体腔道进行液体输送、灌洗 | ||
| ERCP类 | 球囊扩张导管 | 用于扩张胆管系统和总胆管括约肌 | |
| 取石网篮 | 用于取出胆道结石 | ||
| 取石球囊导管 | 用于从胆管系统取出结石、注入造影剂 | ||
| 非血管腔道导丝 | 用于胆管的选择性插管术,并辅助诊断和治疗器械放置;X射线下更清晰 | ||
| 一次性使用胆道引流导管 | 用于排出胆囊及胆管等部位的积液或结石 |
(三)主要产品的工艺流程图
1、基础诊断类
2-2-89
2、止血闭合类
3、ESD类
4、ERCP类
2-2-90
(四)主要经营模式与核心竞争力
1、主要经营模式、盈利模式和结算模式
(1)采购模式
标的公司采购模式主要为采购中心根据年度生产计划及当期的生产任务,考虑维持合理库存量制定采购计划,并向合格供应商下单。报告期内,标的公司的主要采购流程为:①采购中心遴选形成合格供应商名录;②各需求部门(主要包括生产部门及研发部门)填写采购申请单交由采购中心对外下达采购订单或签署采购合同实施采购;③采购物料到货后,由品控部门进行检验或验证,检验合格后方可入库。在供应商管理方面,采购中心对供应商资质、样品、生产能力等进行远程及实地考察,根据考评结果制定合格供应商名录并与其签署年度供货框架协议,并适时调整。
报告期内,标的公司生产所需零配件种类繁多,规格复杂,为提高生产效率,公司将部分弹簧管、磨削导丝、钢丝绳等原材料的加工以及机加工、激光打标等工序委托至外协厂商进行加工。标的公司通过严格的供应商管理制度确保外协加工物料能够满足公司质量的要求。
(2)生产模式
生产部门根据销售计划及订单情况制定生产计划,通过各部门的整体协同运作保证生产工作的正常开展。具体分为如下两种方式:
①订单式生产:按照客户订单的规格及数量,标的公司安排物料采购计划及车间生产计划,该方式主要针对采用贴牌销售模式的客户及海外客户;
②备货式生产:由PMC团队给出次月的备货计划,标的公司直接安排物料采购计划及车间生产计划。
(3)销售模式
1)境内销售方面
2-2-91
在境内销售方面,按销售模式区分,标的公司以经销模式为主,辅以少量直销模式。经销模式下,标的公司通过授权经销商在指定区域经销公司生产或经营的产品以实现收入。根据销售渠道及推广职能不同,经销模式又分为普通经销模式及配送经销模式,标的公司以普通经销模式为主,在少量“两票制”地区实行配送经销模式。普通经销模式下,经销商将承担一定的市场开发及销售拓展职责,标的公司负责向经销商进行产品知识培训,提供必要的技术支持;配送经销模式下,配送商一般只承担产品的配送工作,由标的公司承担市场推广职能。经销模式下,标的公司与经销商的合作方式均为买断式销售。
A、经销商管理体系
标的公司按照指定区域对经销商进行授权。报告期内,标的公司未设置多层级经销商体系,授权经销商面向终端医疗机构进行销售,部分经销商出于自身市场开拓需要通过其下游经销商向终端医院销售,标的公司对经销商发展下游经销商不做限制。
标的公司与境内主要客户采取经销销售的合作模式,为了便于根据市场情况及时调整销售策略,公司一般与国内主要经销商签署年度经销协议,并就产品的授权医院、授权期限、授权产品范围及指导价格、经销商绩效考核、付款方式与期限、产品交付与检验、质量保证、争议的解决等进行约定,公司按照合同约定的销售任务对经销商进行考核,并根据考核结果制定下一年的销售任务与返利政策。
报告期内,与标的公司或其控股子公司直接签署经销协议或订单的境内经销商均取得了《第二类医疗器械经营备案凭证》和/或《医疗器械经营许可证》。
标的公司按照区域(区域系指定的区域或医院)进行产品销售的授权,通常同一授权区域标的公司会授权1-2家经销商进行销售;标的公司未强制要求经销商仅销售标的公司品牌产品,但在经销商日常管理中,原则上要求经销商不销售标的公司品牌之外的同类产品。
报告期内,标的公司存在授权经销商在授权范围内向其下游经销商销售产
2-2-92
品的情形,标的公司未将授权经销商下游经销商纳入管理体系,除上述情形外,标的公司不存在不同层级经销商互相转售的情形。B、定价政策情况标的公司产品价格主要取决于终端销售价格,并依据与经销商合作情况、产品市场需求、产品竞争情况等确定。产品终端销售价格通常为各地省市级通过招标流程确定的挂网或中标价格,经销商向医院销售的终端销售价格不得超过上述挂网价或中标价。C、退换货机制公司制定了相关退换货机制,具体退换货政策如下:
a)凡属产品质量问题,经确认可以退换;b)标的公司设置了免费退换货额度标准,根据经销商上一年的销售总额(不含税)制定退换货比例,结合本年度实际销售额为基数给予免费退换货额度:
上一年销售总额达到1,000万元及以上的经销商,本年度按照本年度实际销售额3%的比例可自由调配产品进行退换货;上一年销售总额达到1,000万元及以下的经销商,本年度按照本年度实际销售额2%的比例可自由调配产品进行退换货;免费退换货额度内的退换货产品必须在标的公司发货之日起6个月内进行退换货,逾期不予退换;因产品质量问题发生的退换货不计入年度退换货额度。c)超出免费退换货额度标准范围需要换货的,标的公司可以酌情配合换货,经销商换货之前必须先经过标的公司确认。对于确认可以换货的产品,标的公司将收取产品售价的30%作为服务费,并且换货产品必须在标的公司发货之日起3个月内进行换货,逾期不予换货。D、退换货机制报告期内,标的公司经销商数量分别为774、737及245个。2021年1-6月标的公司经销商数量大幅减少,主要系标的公司出于经销商管理的考虑,2020年下半年开始进行区域范围内经销商授权的合并,将销售规模较小的授权经销商进行了淘汰。
2-2-93
E、经销商与最终客户的销售方式公司经销商与最终客户的销售方式主要为买断式销售;部分终端医院存在特殊要求,会出现寄售模式销售,对于采用该模式销售的经销商,标的公司与其买断式销售模式并不会发生改变。F、市场推广情况由于我国终端医疗机构众多,分布广阔,因此医疗器械行业通常以经销模式作为销售实现的主要经营模式,相较于医疗器械生产厂商,经销商利用其区位优势更加熟悉授权地区终端医院的主要情况,也更具有在当地进行推广的成本优势。因此,报告期内,标的公司通过与具备一定市场开发能力的经销商进行合作,协助标的公司进行授权区域的市场开发及推广工作。基于上述考虑,标的公司与经销商在市场开发及推广方面的分工及协作情况如下:
a)区域开拓方面,标的公司与经销商配合完成区域招投标工作,完成区域市场开拓。
b)终端入院方面,由经销商负责主要开发及维护工作,标的公司作为专业的医疗器械生产厂商通过技术支持及产品培训等方面协助经销商进行终端医院维护。
c)品牌建设方面,标的公司负责品牌建设,通过举办或者参加学术会议、产品展会等多种方式打造品牌影响力,由经销商负责在授权区域维护标的公司品牌信誉。
除经销商模式外,在“两票制”地区及直销模式下,标的公司均通过与专业推广机构进行合作,配合完成标的公司产品的终端入院流程。在上述两种模式下的客户主要来自于“两票制”实施前的原普通经销商,“两票制”实施后上述客户与配送经销商或标的公司进行交易,在此模式下标的公司将聘请专业第三方机构进行相应的推广及维护工作,上述专业第三方机构通常与原普通经销商共同合作进行医院的开发、管理和维护,具备稳定服务能力。
2-2-94
②直销模式下,标的公司直接将产品销售给终端医疗机构,并独立承担市场开发等职能。按销售产品区分,报告期内,标的公司除销售自有品牌产品外,还代理经销M.I.TECH CO., LTD的金属支架类产品。2)境外销售方面标的公司境外销售以贴牌模式为主,辅以少量经销模式。①贴牌模式下,标的公司依据客户的要求提供生产服务,标的公司主要为ODM模式,即标的公司根据客户的要求,负责提供从研发、设计、生产到后期维护的全部服务,而最终产品贴上客户的商标且由客户负责销售。②经销模式下,标的公司在一个国家或地区通常与1-2家经销商开展合作,由经销商将公司产品销售至终端客户。
(4)盈利模式与结算模式
标的公司作为医疗器械生产厂商,主要通过销售自有产品实现盈利。报告期内,标的公司分别与供应商及经销商约定的结算模式如下:
①与供应商的结算模式
报告期内,标的公司综合考虑采购品种、采购周期、采购金额及与供应商的合作关系等因素确定与供应商的结算方式。一般而言,在原材料验收入库且收到发票后一定期间(多为30天)内支付货款。
②与经销商的结算模式
报告期内,标的公司针对经销商主要为先款后货的模式进行结算,此外综合考虑经销商规模、信用、合作期限等因素,对信用期较好的经销商给予一定的信用期(多为30天)。
2、核心竞争力
(1)产品优势
标的公司在消化内镜耗材领域已经初步完成全产品线的覆盖,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求,有助于标的公司拓宽销售渠道,实现交叉销售。同时,标的公司高度重视产品的质量控制,通过购置高精
2-2-95
度的进口设备,采取先进的生产工艺,使用多种检测手段保证产品质量。标的公司的多项核心产品均已取得欧盟CE、ISO13485、韩国KGMP、MDSAP等国内外权威认证。丰富的产品条线与严格的产品质量控制为标的公司赢得了良好的口碑。在成本方面,公司历来注重成本控制,通过优化产品设计、改进工艺流程、加强过程管理等方式,不断提高生产效率、降低产品成本。报告期内,标的公司与主要供应商均保持多年的良好合作关系,且供应商多数位于常州本地或江浙沪地区,原材料供应及时稳定。标的公司在供应链稳定性和采购价格方面具备竞争优势。从毛利率来看,标的公司报告期各期综合毛利率分别为61.46%、
59.06%和58.76%,南微医学同期毛利率为65.79%、66.03%和65.52%。标的公司毛利率与同行业领先企业处于同一水平。
(2)渠道优势
标的公司深耕内镜诊疗耗材领域多年,通过优质的产品服务与经销商及终端客户建立了较为牢固的联系。
客户开拓方面,经过多年的合作和培育,标的公司积累了一批优秀的、经验丰富的销售团队,并形成了一套行之有效的客户开拓流程。销售团队对产品有着深刻的理解,能有针对性地推荐符合临床需求的产品,并为终端客户提供全方位的专业化服务。标的公司通过优质的产品服务与经销商及终端客户建立了较为牢固的联系,国内营销网络已经基本覆盖全国各个重点城市,相关产品已销往德国、法国、日本、韩国、英国等多个国家和地区。从销售管理模式上看,标的公司为丰富经销商体系,优化渠道管理,已经建立了严格而高效的经销商遴选制度,并与全国各省市、自治区的多家经销商建立了稳定的合作关系,丰富的经销渠道一方面有助于标的公司能够更高效地获悉临床医生的使用需求、找准行业发展契机;另一方面也降低了标的公司在销售过程可能存在的核心客户流失的风险。
临床接触方面,标的公司通过临床拜访,组织学术活动,不断地了解市场的需求与变化,收集到各方尤其是临床终端手术中的痛点,难点。针对性的研发和改进产品,与临床终端建立双赢的医工合作模式,共同推进行业的进步。
2-2-96
(3)品牌优势
标的公司是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业,拥有“久虹”和“唯德康”两个品牌系列产品,围绕内镜诊疗领域进行了系统性的产品布局,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求,具备较强的市场竞争力,曾获得国家级“示范医疗器械企业”、“江苏省著名商标”等荣誉称号。凭借丰富的产品管线、优质的产品质量及优秀的临床使用效果,在行业内树立了较高的市场知名度、品牌影响力和市场份额,已在国内消化内镜器械市场发展中取得先发优势。
(4)管理优势
标的公司拥有一支高素质、专家型管理团队,一直秉承诚信为本、专业经营的宗旨,团结合作,求思奋进。高层管理团队坚持长期可持续发展、注重长远战略规划与核心竞争力的提升,中层管理团队凝聚力高、执行力强,为公司的长期发展奠定了人才基础。公司持续推进安全与精益化生产管理,不断优化体系建设及全面质量管理体系建设,为终端客户和广大患者提供最优质的产品与服务。
3、标的公司产品与同行业公司的技术对比情况
标的公司主要产品与国内外同行业公司同类产品的技术对比情况如下表所示:
2-2-97
(1)止血闭合类
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 产品名称 | 止血闭合类(止血夹) | |||
| 规格型号 | VDK-CD-XX-XXX-X | ROCC-X-XX-XXX | 一次性止血夹 | INSC-X-XXX-X |
| 生产工艺 | 生产工艺属于商业机密,通过公开信息进行工程分析无法完全确认;生产工艺均涉及精密金属与塑料零件加工和组装 | |||
| 核心技术应用 | 1、可同步旋转 2、弹片结构,可重复开合 3、开放式释放结构,释放后无残留 4、降低划伤风险 | 1、精准旋转控制技术 2、不限次重复开闭技术 3、凸轮滑槽闭合技术 4、连发技术 | 1、特殊设计的内外连接结构,可预夹持,误夹无伤拆卸 2、释放器的重复使用,降低了手术的费用。 3、内部布置多个夹子,缩短释放夹子的时间间隔,提高手术效率、降低手 术费用 | 采用弹簧的滑动结构 |
| 应用场景 | 消化道系统里面疾病的治疗,胃肠道止血 | |||
| 检测部位 | 均为胃、十二指肠、大肠等自然腔道 | |||
| 操作友好度 | 1、内芯旋转设计,有利于对不同角度的创面进行夹闭 2、有利于重新定位病灶 3、减少手术异物,降低感染风险 4、手柄释放后锁紧结构,降低划伤组织或内镜的几率 | 1、凸轮滑槽结构,开闭灵敏,阻力小,舒适性高; 2、内芯旋转设计,对接结构及精密焊接技术可以在弯180度精确旋转,对出血部位定位准确,缩短手术时间; 3、最短的硬性长度,可以顺利通过内镜极限弯曲,到达病 | 1、特殊内外连接结构设计,实现可预夹持,反向利用锁定保持原理,误夹下可无损伤拆除 2、采用合理的内外连接结构,使一个止血夹释放器可配合多 个夹头,实现了释放器的重复 | 1、手柄设计借用库克活检钳,弯头180主夹子张开阻力大,舒适度差; 2、可以旋转,但在弯头180度较难旋转对出血部位定位,延长手术时间; 3、当用于内镜下极限位置时,产品易损环; |
2-2-98
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 变部位; 4、滞留长度最短(10.0mm),避免刺激正常组织,不易引发穿孔等风险。 | 使用;每个夹子兼具预夹持或可拆卸功能,降低了手术的费用 3、充分利用止血夹释放器的空间,在其内部布置多个夹子,实现快速衔接缩短释放间隔;提高手术效率、降低手术费用 | 4、滞留长度长,刺激正常组织,易引发穿孔等风险。 | ||
| 核心部件自制度 | 手柄部件外协,其余主要部件自制 | 冲压零件外协,其余核心部件自制及组装 | 核心部件属于商业机密,无法得知 | |
(2)ERCP类
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 产品名称 | ERCP产品 | |||
| 规格型号 | 非血管腔道导丝 VDK -ZGW -XXXXX 胆道引流导管 VDK-EBD-XXXXX 球囊扩张导管 VDK-BD-XXXXX 取石球囊导管 VDK-BAL-XXXXX 三级球囊扩张导管 VDK-TBD-XXXX 括约肌切开刀 VDK-KE-XXXXXX 医用导管夹 VDK-NE 取石网篮 VDK-BAS-XXXXX 内窥镜活检钳 VDK-GFB-XXXX | 导丝锁 MT-XXX-X,MT-XXX-X 鼻胆管 NBDS-XX-XX/XX 导丝 MTN-BM-XX/XX-X-X-X-X 切开刀 DSP-XXX-XX-X-X-X-X-X | 导丝锁 FS-XX-X-X 导丝 METII-XX-XXX 鼻胆管 ENBD-X 切开刀 TRI-XXX-X | 导丝锁 M00545XXX 导丝 M00556XXX 切开刀 M00545XXX |
2-2-99
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 核心技术应用 | 1、弯头技术与亲水涂层技术,不带导丝锁 2、多孔与大内腔的引流设计 3、多种胆胰管的扩张处理方案 4、切开刀头部旋转技术 5、新型的鼻咽管牵拉交换工具 6、更多方案的胆胰系统处理的方案 | 1、一体化的导丝锁结构设计 2、更大流量的结构设计技术 3、导丝加工及涂层技术 4、旋转技术 | 采用常规的钢丝或者镍钛丝等结构 | |
| 应用场景 | 胆胰系统病变的处理 | |||
| 操作友好度 | 1、具有多种不同的头部,适应更为复杂的临床手术, 2、多孔与大内腔设计有利于引流,临床效果更好; 3、多种的扩张方案,有利于胆胰管的扩张,提高器械的通过性及临床效果。 4、切开刀旋转技术,在临床应用中可以适应更为复杂的病变通过旋转进行刀头方向的调整。 5、手柄一体锁紧导管结构,更有利于鼻咽管的交换,降低病患的不适感; 6、更多的胆胰管病例的处理方法与操作,便于临床选择与使用; | 1、一体式的导丝锁结构设计,安装及操作较为方便; 2.内腔和引流孔大,胆汁引流效果更好; 3.导丝研磨加工技术及涂层技术,可确保具有良好的插管性能,与主要竞争对手临床效果无差别;导丝软头为一体式设计,保证软头强度,排除脱落风险。 4.切开刀具有旋转技术,在临床应用中可以适应更为复杂的病变,通过旋转进行刀头方向的调整。 | 1、导丝锁定装置是一体设计的,安装和操作时,相对简单; 2、内腕和引流孔设计小,胆汁引流效果不佳; 3、具有良好的插管性能; 4、切开刀无旋转功能,在临床中无法适应更为复杂的临床环境。 | 1、导丝锁结构和密封帽结构是分体设计的,安装时需要分别安装两个结构,相对而言操作麻烦; 2、导丝具有良好的插管性能; 3、导丝亲水头摩擦系统大,临床反馈头部有脱落的风险; 4、切开刀旋转技术,在临床应用中可以适应更为复杂的病变通过旋转进行刀头方向的调整。 |
| 生产工艺 | 生产工艺属于商业机密,通过公开信息进行工程分析无法完全确认 | |||
| 检测部位 | 主要为胆胰系统病变 | |||
2-2-100
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 核心部件自制度 | 手柄部件外协,其余核心部件自制 | 零部件外协采购回厂装配 | 核心部件属于商业机密,无法得知 | |
(3)ESD类
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 产品名称 | ESD产品 | |||
| 规格型号 | 一次性使用黏膜切开刀VDK-KM-XX-XXX-XX 一次性使用电圈套器VDK-SD-XX-XXX-X 一次性使用热活检钳VDK-FD-XX-XXX-X 一次性内镜用注射针VDK-IN-XX-XXX-X 一次性内窥镜用给药管VDK-ST-XX-XXX-X 一次性使用无菌取样钳VDK-NJM-XX-XXX-X 一次性使用内窥镜用先端帽VDK-LC-X | MK-X-X-XXX | 一次性黏膜切开刀AF-DXXXXXX 一次性电圈套器AF-DXXXXXX 一次性针型注射器AF-DXXXXXX 一次性清洗管AF-DXXXXXX | 一次性使用内窥镜圈套器ATE-XXX-XX 一次性使用内窥镜注射针ATE-XXX-XXXX 一次性使用喷洒管ATE-XXX |
| 核心技术应用 | 1、精密钳头加工工艺,减少术中组织的粘附现象,提高手术效率。 2、顺应性的鞘管设计及制造技术,赋予了产品超柔顺,润滑的性能,即使在极限严苛的情况下,产品也能够顺畅的进出内镜,进行手术操作。 3、隐藏式针头设计,杜绝针头刺出损坏内窥镜及患者,保证了手术的安全性。 4、可旋转的电圈及钳头设计,操作手柄更易抓取病灶部位组织,降低器械操作难度,提高手术效率。 | 1、刀丝涂层技术:减少术中的组织碳化和刀头结痂现象,提高手术效率。 2、顺应性的鞘管设计及制造技术:采用先进的镭射雕刻和高分子覆膜工艺,赋予了产品超柔顺的性能,即使在极限且苛刻的情况下,产品也能够顺畅的进出内镜,进行出刀和收刀的操作 | 采用普通的管鞘、钢丝或者钢丝绳等结构 | 采用普通的管鞘、钢丝或者钢丝绳等结构 |
2-2-101
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 5、独特结构的喷洒头设计,喷洒更均匀,覆盖更广。 | ||||
| 应用场景 | 胃肠道病变组织的切除 | |||
| 操作友好度 | 1、精密的钳头加工工艺,提高手术效率,节约手术时间。 2、顺应性鞘管使产品插入、抽出更顺畅,避免鞘管卡涩导致患者损伤的风险。 3、隐藏式针头设计利于过弯,提高插入的速度及安全性,便于医护人员的对器械的控制。 4、可旋转的电圈及拳头设计,避免误抓取导致的操作不当产生的穿孔等问题。 5、独特设计的喷洒头使喷洒更均匀,效率更高,提高手术效率。 | 1、涂层技术运用,切割效率快,节约手术时间。 2、顺应性鞘管使得刀头进出自如,避免出现刀头过长和过短的问题,引发穿孔的风险; 3、远端部分保持柔软利于过弯,近端部分逐渐增强硬度,以提高插入的速度同时便于医护人员对器械的控制。 4、刀头无方向性,避免操作不当产生的穿孔。 | 1、管鞘顺应性差,管鞘比较粗,导致吸引效果变差。 2、导引头未能覆盖针尖,导致针尖裸露,有刺穿管鞘损坏内窥镜的风险。 3、电圈旋转性不良,不能准确定位到病灶部位。 4、喷洒头设计较大,喷洒液体颗粒大,不能均匀的喷洒到病灶部位。 | 1、管鞘太软,插入需缓慢,易弯折。 2、导引头未能覆盖针尖,导致针尖裸露,有刺穿管鞘损坏内窥镜的风险。 3、电圈不能旋转,不能准确定位到病灶部位。 4、喷洒头设计较大、较长,插入内窥镜困难,易损伤内窥镜钳道。 |
| 生产工艺 | 生产工艺属于商业机密,通过公开信息进行工程分析无法完全确认 | |||
| 检测部位 | 均为胃、十二指肠、大肠等自然腔道 | |||
| 核心部件自制度 | 手柄部件外协,其余主要核心部件自制 | 涂层外协,其余核心部件自制及组装 | 核心部件是否自制属于商业机密,无法得知 | |
(4)泌尿类
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
2-2-102
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 产品名称 | 泌尿产品 | |||
| 规格型号 | 一次性使用泌尿道导丝VDK-UGW-XX-XXXX 一次性使用取石网篮VDK-UBS-XXXXXX 一次性使用输尿管导引鞘VDK-USA-XXXXX 镍钛合金泌尿系统取石网VDK-SC-XXXXX 输尿管扩张球囊导管VDK -UBD -XXXXX 一次性使用输尿管支架VDK-USF -XXXXX | 非血管腔道导丝 输尿管导扩张球囊导管 输尿管导引鞘 泌尿取石网篮 封堵拦截导管 输尿管支架管 | 一次性使用输尿管导引鞘 取石网篮 封堵网篮(螺旋行) 输尿管支架 一次性使用输尿管球囊扩张管 | 泌尿导丝 取石网篮 输尿管支架 输尿管扩张球囊导管 输尿管鞘 镍钛合金泌尿系统取石网 |
| 核心技术应用 | 1、芯丝磨屑技术及涂层技术,保证插入性能 2、超细外径,复合外管,支撑性强,花瓣型头部易抓取结石 3、人体工程学设计,贴合人体曲线,表面涂层技术 4、亲水显影软头设计,插入更安全,螺旋结构设计,封堵放开随心切换 5.、囊体成型技术,超高耐压,扩展效果更好,且更安全 6、管材成型技术,涂层技术 | 采用常规的钢丝或者镍钛丝等结构 | ||
| 应用场景 | 泌尿道系统病变的处理 | |||
| 操作友好度 | 1、超滑涂层,斑马纹路视眼清晰 2、超强支撑的外管,花瓣型仿型抓取,简单快捷 3、涂层技术,插入性能好,且不伤组织 4、亲水软头设计,螺旋设计,结构巧妙且 | 1、斑马纹路视眼清晰 2、三瓣型抓取 3、涂层技术,插入性能好,且不伤组织 4、无亲水软头设计,螺旋设 | 1、斑马纹路视眼清晰 2、三瓣型抓取 3、涂层技术,插入性能好,且不伤组织 4、无亲水软头设计,叶片设 | 1、斑马纹路视眼清晰 2、三瓣型抓取 3、涂层技术,插入性能好,且不伤组织 4、无亲水软头设计,叶片设计 |
2-2-103
| 可比公司 | 唯德康医疗 | 可比公司1 | 可比公司2 | 可比公司3 |
| 方便 5、超高耐压,独特管腔设计,充泄压更快速 6、材质软硬适中,有涂层,有温敏特征 | 计 5、充泄压速度未知,结构相似 6、特征不明显 | 计 5、充泄压速度未知,结构相似 6、特征不明显 | 5、充泄压速度未知,结构相似 6、特征不明显 | |
| 生产工艺 | 生产工艺属于商业机密,通过公开信息进行工程分析无法完全确认 | |||
| 检测部位 | 均为泌尿系统等自然腔道 | |||
| 核心部件自制度 | 手柄部件外协,其余核心部件自制 | 核心部件属于商业机密,无法得知 | ||
2-2-104
(五)主要产品的生产和销售情况
1、主要产品的产能、产量和销量情况
报告期内,标的公司主要产品的产能、产量和销量情况如下:
单位:万件、%
| 产品类别 | 项目 | 2021年1-6月 | 2020年度 | 2019年度 |
| 基础诊断类 | 产能 | 350.67 | 540.57 | 485.65 |
| 产量 | 380.24 | 455.06 | 513.12 | |
| 销量 | 369.77 | 470.98 | 455.94 | |
| 产能利用率 | 108.43% | 84.18% | 105.66% | |
| 产销率 | 97.25% | 103.50% | 88.86% | |
| 止血闭合类 | 产能 | 69.41 | 110.94 | 84.19 |
| 产量 | 61.52 | 74.65 | 74.61 | |
| 销量 | 55.18 | 80.76 | 59.95 | |
| 产能利用率 | 88.63% | 67.29% | 88.63% | |
| 产销率 | 89.70% | 108.19% | 80.34% | |
| ESD类 | 产能 | 48.41 | 85.08 | 48.73 |
| 产量 | 44.22 | 56.59 | 41.79 | |
| 销量 | 43.15 | 51.45 | 38.43 | |
| 产能利用率 | 91.35% | 66.51% | 85.75% | |
| 产销率 | 97.57% | 90.92% | 91.97% | |
| ERCP类 | 产能 | 6.70 | 18.86 | 11.26 |
| 产量 | 8.57 | 17.80 | 12.24 | |
| 销量 | 8.97 | 12.47 | 10.58 | |
| 产能利用率 | 127.85% | 94.38% | 108.67% | |
| 产销率 | 104.69% | 70.06% | 86.46% |
注1:产能=每年每人工作总时长*生产员工人数/标准工时,其中单名生产员工生产时间按照每年生产300 天、每天执行1班次、每班8小时的情况计算注2:以上产量为产成品口径,不包括自制半成品注3:产能利用率=产量/产能,产销率=销量/产量
2、主要产品的销售情况
(1)主营业务收入按区域划分
报告期内,标的公司主营业务收入按区域划分情况如下:
2-2-105
单位:万元
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 | |||
| 金额 | 占比 | 金额 | 占比 | 金额 | 占比 | |
| 境内 | 12,691.45 | 58.17% | 23,349.94 | 62.45% | 15,674.02 | 58.08% |
| 境外 | 9,125.30 | 41.83% | 14,040.53 | 37.55% | 11,312.89 | 41.92% |
| 合计 | 21,816.75 | 100.00% | 37,390.48 | 100.00% | 26,986.91 | 100.00% |
注:境外指港澳台和其他外国国家和地区
(2)主营业务收入按产品类别划分
报告期内,标的公司主要产品的销售情况如下:
单位:万元
| 项目 | 产品类别 | 2021年1-6月 | 2020年度 | 2019年度 | |||
| 金额 | 占比 | 金额 | 占比 | 金额 | 占比 | ||
| 消化内镜医疗器械 | 基础诊断类 | 10,074.95 | 46.18% | 14,127.51 | 37.78% | 13,140.56 | 48.69% |
| 止血闭合类 | 4,084.95 | 18.72% | 5,719.69 | 15.30% | 4,806.88 | 17.81% | |
| ERCP类 | 3,386.77 | 15.52% | 5,590.93 | 14.95% | 4,623.62 | 17.13% | |
| ESD类 | 2,200.79 | 10.09% | 2,969.93 | 7.94% | 2,071.49 | 7.68% | |
| 其他产品 | 泌尿骨科类医疗器械 | 1,162.30 | 5.33% | 1,654.16 | 4.42% | 1,566.50 | 5.80% |
| 医用配件 | 241.87 | 1.11% | 277.70 | 0.74% | 138.98 | 0.51% | |
| 口罩 | 3.75 | 0.02% | 6,090.60 | 16.29% | - | - | |
| 金属支架类医疗器械(贸易) | 661.37 | 3.03% | 959.97 | 2.57% | 638.87 | 2.37% | |
| 合计 | 21,816.75 | 100.00% | 37,390.48 | 100.00% | 26,986.91 | 100.00% | |
(3)主要产品单价情况
报告期内,标的公司主要产品的销售单价情况如下:
单位:元
| 产品类别 | 2021年1-6月 | 2020年度 | 2019年度 |
| 基础诊断类 | 20.23 | 20.33 | 19.63 |
| 止血闭合类 | 74.04 | 70.82 | 80.19 |
| ESD类 | 51.00 | 57.73 | 53.90 |
| ERCP类 | 377.60 | 444.45 | 433.65 |
报告期内标的公司各类产品单价保持稳定,其中,相较于2020年度,标的
2-2-106
公司2021年1-6月ERCP类产品单价下降较多,主要系当期该类别产品销售结构发生变化,单价较低的非血管腔道导丝销售量较大所致。报告期内,标的公司前五大客户销售收入合计占比不超过45%,不存在对单一客户的重大依赖。报告期内,标的公司董事、监事、高级管理人员和核心技术人员,其他主要关联方或持有标的公司5%以上股份的股东在上述客户中未占有任何权益。
3、报告期内唯德康医疗前五大客户情况
报告期内,标的公司境内以经销模式为主要销售模式,境外以ODM模式为主要销售模式,以下按照销售模式分别列示报告期内前五大客户情况。
报告期各期,标的公司境内经销商模式下,前五大客户收入情况如下:
单位:万元
| 期间 | 序号 | 客户名称 | 销售内容 | 金额 | 占境内营业收入的比例 |
| 2021年1-6月 | 1 | 杭州千生汇科技有限公司及其关联公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 1,563.82 | 12.32% |
| 2 | 杭州珠玑贸易商行 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 615.12 | 4.85% | |
| 3 | 西安佑远医疗器械有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 614.67 | 4.84% | |
| 4 | 济南市元优医疗科技有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 400.94 | 3.16% | |
| 5 | 常州市鹏沃贸易有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 344.37 | 2.71% | |
| 小计 | 3,538.92 | 27.88% | |||
| 2020年度 | 1 | 江苏舜天国际集团机械进出口有限公司及其关联公司 | 口罩 | 4,024.37 | 17.24% |
| 2 | 杭州千生汇科技有限公司及其关联公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 2,153.17 | 9.22% | |
| 3 | 西安佑远医疗器械 | 基础诊断类、ERCP类、 | 1,412.43 | 6.05% | |
2-2-107
| 期间 | 序号 | 客户名称 | 销售内容 | 金额 | 占境内营业收入的比例 |
| 有限公司 | ESD类、止血闭合类等 | ||||
| 4 | 河北迈得森医疗器械贸易有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 704.84 | 3.02% | |
| 5 | 济南市元优医疗科技有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 683.00 | 2.93% | |
| 小计 | 8,977.81 | 38.46% | |||
| 2019年度 | 1 | 杭州千生汇科技有限公司及其关联公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 1,563.39 | 9.97% |
| 2 | 河北迈得森医疗器械贸易有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 583.32 | 3.72% | |
| 3 | 济南市元优医疗科技有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 573.16 | 3.66% | |
| 4 | 西安佑远医疗器械有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 532.98 | 3.40% | |
| 5 | 常州市鹏沃贸易有限公司 | 基础诊断类、ERCP类、ESD类、止血闭合类等 | 488.44 | 3.12% | |
| 小计 | 3,741.29 | 23.87% | |||
注1:杭州千生汇科技有限公司及其关联公司系指杭州千生汇科技有限公司、杭州昱熠科技有限公司注2:江苏舜天国际集团机械进出口有限公司及其关联公司系指江苏舜天国际集团机械进出口有限公司、江苏舜天国际集团苏迈克斯工具有限公司注3:杭州珠玑贸易商行与标的公司的业务关系承接自河北迈得森医疗器械贸易有限公司注4:以上前五大客户均按同一控制下合并计算报告期各期,标的公司境外ODM模式下,前五大客户收入情况如下:
单位:万元
| 期间 | 序号 | 客户名称 | 销售内容 | 金额 | 占境外收入的比例 |
| 2021年1-6月 | 1 | PENTAX EUROPE GMBH | 基础诊断类、ERCP类、ESD类、止血闭合类 | 2,755.12 | 30.19% |
| 2 | LIFE PARTNERS EUROPE及其关联公司 | 基础诊断类、ESD类、止血闭合类 | 2,322.48 | 25.45% |
2-2-108
| 期间 | 序号 | 客户名称 | 销售内容 | 金额 | 占境外收入的比例 |
| 3 | FUJIFILM MEDWORK GMBH | 基础诊断类、ERCP类、止血闭合类 | 901.74 | 9.88% | |
| 4 | MTW-ENDOSKOPIE W. HAAG KG | 基础诊断类、ERCP类、ESD类 | 546.73 | 5.99% | |
| 5 | MEDITALIA | 基础诊断类、ERCP类、ESD类、止血闭合类 | 294.19 | 3.22% | |
| 小计 | 6,820.27 | 74.74% | |||
| 2020年度 | 1 | LIFE PARTNERS EUROPE及其关联公司 | 基础诊断类、ERCP类、ESD类、止血闭合类、口罩 | 4,853.03 | 34.56% |
| 2 | MTW-ENDOSKOPIE W. HAAG KG | 基础诊断类、ERCP类、ESD类、止血闭合类 | 2,348.61 | 16.73% | |
| 3 | FUJIFILM MEDWORK GMBH | 基础诊断类、ERCP类、止血闭合类、口罩 | 1,797.28 | 12.80% | |
| 4 | MEDITALIA | 基础诊断类、ERCP类、ESD类 | 550.81 | 3.92% | |
| 5 | PENTAX EUROPE GMBH | 基础诊断类、ESD类、止血闭合类 | 474.40 | 3.38% | |
| 小计 | 10,024.13 | 71.39% | |||
| 2019年度 | 1 | LIFE PARTNERS EUROPE及其关联公司 | 基础诊断类、ERCP类、ESD类、止血闭合类 | 3,250.52 | 28.73% |
| 2 | FUJIFILM MEDWORK GMBH | 基础诊断类、ERCP类、ESD类、止血闭合类 | 2,013.11 | 17.79% | |
| 3 | MTW-ENDOSKOPIE W. HAAG KG | 基础诊断类、ERCP类、ESD类、止血闭合类 | 1,921.56 | 16.99% | |
| 4 | MEDITALIA | 基础诊断类、ERCP类、ESD类 | 559.26 | 4.94% | |
| 5 | G-FLEX EUROPE SPRL | 基础诊断类、ERCP类、ESD类、止血闭合类 | 445.14 | 3.93% | |
| 小计 | 8,189.59 | 72.38% | |||
注1:LIFE PARTNERS EUROPE及其关联公司系指LIFE PARTNERS EUROPE、Vytil Sarl注2:以上前五大客户均按同一控制下合并计算
报告期内,标的公司不存在对单一客户的重大依赖。报告期内,标的公司董事、监事、高级管理人员和核心技术人员,其他主要关联方或持有标的公司5%以上股份的股东在上述客户中未占有任何权益。
2-2-109
4、报告期内唯德康医疗境外主要贴牌客户情况
报告期内,合计销售收入排名前十大的境外贴牌客户情况如下:
2-2-110
| 序号 | 客户名称 | 国别 | 客户品牌 | 主要销售产品 | 合作起始时间 | 开发方式 |
| 1 | LIFE PARTNERS EUROPE及其关联公司 | 法国 | LIFE、VYTIL | 活检阀/一次性使用息肉切除器/一次性使用活体取样钳/内窥镜用异物钳/一次性使用电圈套器/一次性内镜用注射针/一次性使用消化道软组织夹/活检阀/一次性使用口垫/球囊扩张导管/食道贲门狭窄扩张器/一次性使用冷圈套器/一次性使用内镜给药管/清洁刷/一次性使用细胞刷/一次性使用热活检钳 | 2015年 | 展会 |
| 2 | FUJIFILM MEDWORK GMBH | 德国 | MEDWORK | 球囊扩张导管/医用球囊压力泵/一次性使用活体取样钳/内窥镜用异物钳 | 2008 | 展会 |
| 3 | MTW-ENDOSKOPIE W. HAAG KG | 德国 | MTW | 贲门食道狭窄扩张器/内窥用异物钳/取石球囊/活检阀/非血管腔道导丝/一次性使用活体取样钳/一次性内镜用注射针 | 2012 | 展会 |
| 4 | PENTAX EUROPE GMBH | 欧洲各国 | PENTAX | 一次性使用消化道软组织夹/一次性使用冷圈套器/一次性使用活体取样钳/内窥镜用异物钳/一次性内镜用注射针/一次性使用电圈套器/一次性使用内镜给药管 | 2020 | 自主接洽 |
| 5 | MEDITALIA | 意大利 | ITAFLEX | 内窥用异物钳/一次性使用息肉切除器/取石网篮/取石球囊/活检阀/非血管腔道导丝/硬化剂注射针 | 2011 | 展会 |
| 6 | G-FLEX EUROPE SPRL | 比利时 | G-FLEX | 一次性使用止血夹/一次性使用活体取样钳/内窥用异物钳/非血管腔道导丝/硬化剂注射针/一次性使用息肉切除器 | 2012 | 展会 |
| 7 | BMA CO., LTD. | 韩国 | BMA | 一次性使用活体取样钳/一次性使用息肉切除器 | 2019 | 自主接洽 |
| 8 | NU-LIFE MEDICAL & SURGICAL SUPPLIES INC. | 加拿大 | Nu-Life | 清洁刷/一次性使用止血夹/一次性使用活体取样钳/硬化剂注射针/一次性使用口垫/一次性使用息肉切除器 | 2009 | 展会 |
| 9 | HTS TECNOLOGIA EM SAúDE. COM. IMP. E EXP. LTDA | 巴西 | Medica | 取石网篮/球囊扩张导管/清洁刷/一次性使用活体取样钳/内窥用异物钳/硬化剂注射针/一次性使用口垫/一次性使用息肉切除器/非血管腔道导丝 | 2011 | 展会 |
| 10 | MEDISWEEP. CO.,LTD. | 韩国 | Medisweep | 一次性使用电圈套器/一次性内镜用注射针/一次性使用活体取样钳 | 2018 | 自主接洽 |
2-2-111
为保证产品的性能与质量稳定性,境外贴牌客户具有较强的业务粘性,一般不会轻易更换主要的合作厂商。多数境外贴牌客户与标的公司保持了长期和稳定的合作。经检索进口医疗器械产品在国家药品监督管理局的注册信息,少量贴牌客户存在在中国销售消化内镜诊疗器械产品的情况,如MTW-ENDOSKOPIE W. HAAGKG在境内销售取石网篮、电圈套器等产品,但上述产品与标的公司向其销售的产品不存在重合,贴牌客户不存在将标的公司产品返销回中国与标的公司形成竞争的情况。在贴牌销售模式下,标的公司主要为ODM模式,即标的公司根据客户的要求,负责提供从研发、设计、生产到后期维护的全部服务,而最终产品贴上客户的商标且由客户负责销售。与国内销售产品相比,除部分贴牌厂商在颜色和规格方面进行少数定制化改进外,境外贴牌产品在主要类别、功能、使用方法上不存在重大差异,标的公司拥有贴牌产品包括专利在内的知识产权。
标的公司产品的销售区域包括德国、法国、日本、韩国、英国等多个国家和地区,如使用自有品牌对外销售,标的公司需要配置相应的境外销售团队和售后服务团队。因此,为了拓宽标的公司收入来源,在国际市场开拓初期迅速进行扩张,标的公司在境外主要采取贴牌销售模式进行探索和布局。
5、国内最终客户中三甲医院数量及覆盖率,公立医院和民营医院的销售情况
(1)国内最终客户中三甲医院数量及覆盖率
截至2021年6月,标的公司产品覆盖了全国2,635家医院,其中三甲医院834家,三甲医院占比32%,根据《中国卫生健康统计年鉴2020》,我国2019年三甲医院数量为2,749家,标的公司国内三甲医院覆盖率为30.34%。
(2)公立医院和民营医院的销售情况
报告期内,标的公司分医院类型的销售情况如下:
单位:家、万元
| 期间 | 医院性质 | 医院数量 | 销售金额 |
2-2-112
| 期间 | 医院性质 | 医院数量 | 销售金额 |
| 2021年1-6月 | 公立 | 2,473 | 11,152.76 |
| 民营 | 162 | 586.99 | |
| 混合 | - | - | |
| 合计 | 2,635 | 11,739.74 | |
| 2020年度 | 公立 | 2,082 | 15,757.58 |
| 民营 | 116 | 495.29 | |
| 混合 | 5 | 20.00 | |
| 合计 | 2,203 | 16,272.87 | |
| 2019年度 | 公立 | 1,695 | 13,354.00 |
| 民营 | 57 | 247.00 | |
| 混合 | 107 | 570.25 | |
| 合计 | 1,859 | 14,171.25 |
注:标的公司主要通过经销商销售至终端医疗机构,故无法统计终端医疗机构最终采购金额,因此以标的公司出厂价格及终端医疗机构的采购数量测算相应销售金额
(六)主要产品的采购及供应情况
1、主要原材料采购情况
报告期内,标的公司采购的原材料主要包括塑料管材、弹簧钢丝、注塑件等。报告期内,标的公司采购主要原材料的金额及平均单价情况如下:
单位:万元、元/个、元/根、元/米
| 原材料类型 | 2021年1-6月 | 2020年 | 2019年 | |||
| 金额 | 单价 | 金额 | 单价 | 金额 | 单价 | |
| 塑料管材类 | 1,618.25 | 3.76 | 2,024.00 | 3.80 | 1,727.75 | 3.13 |
| 弹簧钢丝类 | 1,309.43 | 1.49 | 1,634.11 | 0.80 | 1,676.45 | 0.72 |
| 注塑件类 | 682.13 | 0.33 | 812.93 | 0.31 | 813.94 | 0.30 |
| 包材类 | 546.18 | 1.16 | 791.93 | 0.98 | 773.33 | 0.84 |
| 清洁刷具类 | 216.40 | 2.30 | 277.21 | 2.53 | 392.91 | 2.50 |
| 合计 | 4,372.39 | - | 5,540.18 | - | 5,384.38 | - |
| 总计 | 6,780.14 | - | 9,645.70 | - | 8,438.91 | - |
相较于2020年度,标的公司2021年1-6月弹簧钢丝类产品单价上升较多,主要系当期该类别原材料采购结构发生变化,单价较高的取样钳用钢丝绳采购量较大所致。除此之外,报告期内,标的公司主要原材料的单价基本稳定,在
2-2-113
合理范围内波动,不存在采购异常情形。
2、主要能源供应情况
报告期内,标的公司生产所需的主要能源为电力及水,市场供应充足。
3、外协加工情况
报告期内,标的公司的外协工序主要有弹簧管、磨削导丝、钢丝绳等原材料的加工以及机加工、激光打标等工序。该等工序均系普通加工工序,并非标的公司关键工序,不涉及关键技术。针对标的公司向外协厂商提供的加工图纸等技术资料,标的公司已与外协厂商在合同协议中明确约定了保密义务。报告期内,外协加工金额及占当期采购比例情况如下:
单位:万元
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 | |||
| 金额 | 占比 | 金额 | 占比 | 金额 | 占比 | |
| 外协金额 | 592.74 | 7.98% | 748.94 | 6.91% | 733.01 | 8.00% |
针对外协加工生产质量管理,标的公司制定了《采购控制程序》、《质量控制程序》、《不合格品控制程序》、《纠正、预防和改进措施控制程序》等制度,由公司采购中心负责对外协供方的调查评价和选择工作,并保持与外协供方的沟通,由品控部对外协供方提供产品质量的检测,质量中心负责对供方的质量体系进行评定。
确定外协供方后,标的公司与外协厂商签订合同或采购订单,并在合同或采购订单中确定产品的工艺及参数要求。在收到外协产品后,由品控部按照图纸、技术要求对外协产品进行检验,确保外协产品满足标的公司质量要求。
报告期内,标的公司严格执行上述对外协生产质量管理的相关制度,外协质量控制情况良好,未出现因外协生产质量问题而导致公司相关产品出现重大质量问题的情况。
针对外协供方选择,标的公司制定了一系列供方评价程序,外协供应商评价包含在内。报告期内,标的公司按照采购产品对过程或成品的影响程度高低,将供应商依次分为A、B、C、D四类,具体情况如下:
2-2-114
| 供应商 分类 | 定义 | 主要产品 | 供应商筛选标准 |
| A类 | 对公司过程或成品质量有重大影响的产品 | 镍钛合金丝、初包装袋、钳头、球囊等 | 具备法律法规及行业规定的有效生产资质;符合产品质量执行标准;供应商的生产能力、生产设备、企业规模等符合评定要求;交货能力及时、供货信誉较高 |
| B类 | 对公司过程或成品质量有一定影响的产品 | 手柄组件、不锈钢丝、硅胶件等 | |
| C类 | 对公司过程或成品质量影响较小或一次性采购使用的产品 | 各类纸盒包装、标签等 | |
| D类 | 为公司提供服务性质的供应商 | 检测服务、注册服务、虫害控制等 | 具备法律法规及行业规定的有效生产资质;企业基础设施及规模符合评定要求;服务能力及信誉较好 |
合格供应商评定过程中由采购中心负责供应商的初步调查,主要包括生产资格审定、产品质量及执行标准、生产能力、企业规模等多个维度,作为选择供方的依据;后由采购中心通知供应商提供样品及有关资料,样品经由技术研发部检验;样品检验合格后,安排批量试用,经标的公司评审合格后纳入合格供方名单。报告期内,标的公司前五大外协厂商较为稳定,具体情况如下:
单位:万元
| 期间 | 序号 | 外协厂商名称 | 加工内容 | 金额 | 占委托加工费用合计比例 |
| 2021年1-6月 | 1 | 武进区湖塘岳勤五金厂及其关联公司 | 弹簧管加工 | 268.47 | 45.29% |
| 2 | 武进区湖塘乾广机械厂 | 磨削导丝加工 | 81.38 | 13.73% | |
| 3 | 常州市常睿金属制品有限公司 | 钢丝绳加工 | 59.46 | 10.03% | |
| 4 | 武进高新区铧益电子厂 | 机加工 | 58.49 | 9.87% | |
| 5 | 常州市宝涵机械科技有限公司 | CD-缺口拉杆加工 | 39.72 | 6.70% | |
| 小计 | 507.51 | 85.62% | |||
| 2020年度 | 1 | 武进区湖塘岳勤五金厂及其关联公司 | 弹簧管加工 | 336.90 | 44.98% |
| 2 | 武进区湖塘乾广机械厂 | 磨削导丝加工 | 102.53 | 13.69% | |
| 3 | 武进高新区铧益电子厂 | 机加工 | 79.60 | 10.63% | |
| 4 | 常州市常睿金属制品有限公司 | 钢丝绳加工 | 64.74 | 8.64% | |
2-2-115
| 期间 | 序号 | 外协厂商名称 | 加工内容 | 金额 | 占委托加工费用合计比例 |
| 5 | 常州雅泽五金配件有限公司 | 弹簧管加工 | 42.02 | 5.61% | |
| 小计 | 625.78 | 83.56% | |||
| 2019年度 | 1 | 武进区湖塘岳勤五金厂及其关联公司 | 弹簧管加工 | 375.73 | 51.26% |
| 2 | 常州市常睿金属制品有限公司 | 钢丝绳加工 | 108.77 | 14.84% | |
| 3 | 武进高新区铧益电子厂 | 机加工 | 61.20 | 8.35% | |
| 4 | 武进区湖塘乾广机械厂 | 磨削导丝加工 | 60.03 | 8.19% | |
| 5 | 常州市武进区洛阳纳克模具加工厂 | 丝印 | 43.68 | 5.96% | |
| 小计 | 649.41 | 88.59% | |||
注:武进区湖塘岳勤五金厂已于2020年11月注销,武进区湖塘儒诚五金厂成立于2020年11月,为承接武进区湖塘岳勤五金厂业务而设立的主体
4、报告期内唯德康医疗前五大供应商情况
报告期内,唯德康医疗对前五大供应商采购情况如下:
单位:万元
| 序号 | 供应商名称 | 金额 | 占比 |
| 2021年1-6月 | |||
| 1 | 上海茸原氟塑料制品有限公司 | 963.74 | 12.76% |
| 2 | 常州市武进区洛阳纳克模具加工厂及其关联公司 | 652.97 | 8.64% |
| 3 | 杭州鑫泽源精密制品有限公司 | 604.30 | 8.00% |
| 4 | 常州市常睿金属制品有限公司及其关联公司 | 595.52 | 7.88% |
| 5 | M.I.TECH CO., LTD | 306.75 | 4.06% |
| 合计 | 3,123.27 | 41.35% | |
| 2020年 | |||
| 1 | 上海茸原氟塑料制品有限公司 | 1,050.30 | 9.70% |
| 2 | 常州市武进区洛阳纳克模具加工厂及其关联公司 | 820.86 | 7.58% |
| 3 | 常州市常睿金属制品有限公司及其关联公司 | 751.99 | 6.94% |
| 4 | 杭州鑫泽源精密制品有限公司 | 616.86 | 5.69% |
| 5 | M.I.TECH CO., LTD | 572.63 | 5.29% |
| 合计 | 3,812.64 | 35.20% | |
2-2-116
| 序号 | 供应商名称 | 金额 | 占比 |
| 2019年 | |||
| 1 | 常州市武进区洛阳纳克模具加工厂及其关联公司 | 839.42 | 9.16% |
| 2 | 上海茸原氟塑料制品有限公司 | 802.13 | 8.75% |
| 3 | 杭州鑫泽源精密制品有限公司 | 752.39 | 8.21% |
| 4 | 常州市常睿金属制品有限公司及其关联公司 | 734.35 | 8.01% |
| 5 | 普适精密机械科技(昆山)有限公司 | 517.38 | 5.64% |
| 合计 | 3,645.68 | 39.77% | |
注1:常州市武进区洛阳纳克模具加工厂及其关联公司系指常州市武进区洛阳纳克模具加工厂、常州市唯久塑料制品有限公司注2:常州市常睿金属制品有限公司及其关联公司系指常州市常睿金属制品有限公司、新北
区奔牛康得塑胶管件厂
注3:常州市武进区洛阳纳克模具加工厂及其关联公司及常州市常睿金属制品有限公司及其
关联公司采购产品包括原材料及外协加工服务
注4:以上前五大供应商均按同一控制下合并计算
报告期内,唯德康各年度前五大供应商采购比例始终低于45%,不存在对单一供应商有重大依赖的情形。
上述主要供应商中,常州雅泽五金配件有限公司、常州市常睿金属制品有限公司及新北区奔牛康得塑胶管件厂为标的公司关联方,具体交易情况详见本报告书“第十一节 同业竞争和关联交易”之“二 本次交易对关联交易的影响”之“(二)本次交易完成前,唯德康医疗的关联交易情况”。
除上述情形外,报告期内标的公司董事、监事、高级管理人员和核心技术人员,其他主要关联方或持有标的公司5%以上股份的股东在上述供应商中未拥有任何权益。
(七)安全生产和环保情况
标的公司主要从事消化内镜领域医疗器械研发、生产、销售,其所在的专用设备制造行业不属于高危险、重污染行业,标的公司日常经营活动不存在重污染环节。公司针对生产过程中产生的废水、废气、固废,均采取了妥善的治理措施。
2-2-117
(八)主要产品和服务的质量控制情况
1、质量管理体系
标的公司自成立以来一直致力于建立并不断完善质量保证体系。唯德康医疗已经取得欧盟CE、ISO13485、韩国KGMP、MDSAP等国内外权威认证。上述质量认证管理体系作为唯德康医疗产品研发、生产、销售和服务内部控制等方面的质量管理指导标准,在唯德康医疗内部得到了严格有效执行,覆盖了主要产品的研发、生产和服务的全过程。
2、质量管理措施
标的公司制定了严密的质量管理措施,确保质量管理覆盖从原材料采购到半成品再到成品出厂的各个环节,严格实施标准化管理和控制,确保产品的品质、 质量与安全。
3、质量纠纷
标的公司自成立以来始终高度重视客户以及终端客户对产品和服务的质量反馈信息,制定了记录、统计、原因分析、解决方案售后管理全流程,并在实际售后服务的过程中严格执行。唯德康医疗自成立以来,未发生过重大质量纠纷的情形。标的公司报告期内不存在质量事故或纠纷,亦未发生产品召回事件。
4、质量控制制度的有效实施
为保障产品质量控制制度的有效实施,标的公司在日常生产经营活动中严格执行相应的质量管理制度及程序规范,具体情况如下:
2-2-118
| 业务环节 | 质量控制制度的实施情况 |
| 产品设计开发 | 标的公司制订了《设计和开发控制程序》,技术研发部负责完成产品的设计开发过程;国内/国际营销中心负责为设计开发提供市场分析及用户需求等资料;工艺部负责生产转换过程中的相关验证或确认活动;质量中心、品控部、生产部、工艺部等部门参与正式设计评审;国内/国际法规注册部为确保设计开发过程符合国内/国外相关法律、法规的要求提出意见。 |
| 采购环节 | 标的公司制订了《采购控制程序》,通过对供方进行评价选择,对采购全过程进行控制,保证采购产品符合规定质量要求。技术研发部负责编制物料清单并根据原材料对过程或最终成品质量影响的重要程度进行分类;采购中心负责组织对供方的调查评价和选择工作,外购原辅材料、生产设备、检测设备及其零部件的采购的购置实施,并保持与供方的沟通和处理质量争端事宜;PMC(生产及物料控制部)负责编制采购计划、采购订单及供方供货记录统计;品控部负责对供方提供产品质量的检测;质量中心负责对供方质量体系的评定。 |
| 生产环节 | 标的公司制订了《生产和服务提供控制程序》,生产部负责生产任务的安排、调度、生产过程的管理及生产设备、测量设备和生产环境的日常管理和控制;PMC(生产及物料控制部)负责生产所需的原材料采购及外协件委外加工;工艺部负责提供产品工艺文件、各工序作业指导书、生产过程中的技术支持;人力行政中心负责人员培训及参与基础设施、生产环境检查监督。 |
| 产品检验/不合格产品处理 | 标的公司制订了《过程与产品监视和测量控制程序》《不合格品控制程序》等程序文件。品控部负责原材料、外购外协件检验,过程产品检验、成品检验等质量控制;生产部负责生产过程中的在制品、原辅料、外协件、包装材料及半成品等按标准处理流程进行隔离及标准处置范围内的返修及报废品处置,参与不合格品的评审;质量中心对检验员识别的非标准处置的不合格品组织评审处置,评估让步、返工返修的风险,组织各相关部门制定整改措施并跟踪。 |
标的公司在产品设计开发、采购、生产、产品检验等环节的产品质量控制制度得到有效实施。
(九)核心技术情况
唯德康医疗自成立以来,高度重视核心技术的研发与经验积累,已形成并掌握了多项核心技术,并建立起一支研发素质高、创新能力强、经验丰富的核心技术团队,为标的公司在消化内镜器械行业的快速发展与壮大打下了坚实基础。
1、主要核心技术情况
(1)主要核心技术、专利授权及技术来源情况
报告期内,唯德康医疗的主要核心技术、专利授权及技术来源情况如下:
2-2-119
| 序号 | 类别 | 核心技术 | 是否已授权专利 | 对应专利号 | 技术来源 |
| 1 | 基础诊断类 | 支架或导管体内疏通技术 | 是 | 201820065605.2 | 自主研发 |
| 2 | ESD类 | 用齿轮与齿条的配合,控制针尖伸出外管的距离 | 是 | 201720253389.X | 自主研发 |
| 3 | ESD类 | 内镜下切割剥离黏膜下组织 | 是 | 201520044033.6 | 自主研发 |
| 4 | ESD类 | 可分离的钳头架夹持组织 | 是 | 201420174360.9 | 自主研发 |
| 5 | ESD类 | 偏心锁紧装置锁紧滑套位置 | 是 | 201720137252.8 | 自主研发 |
| 6 | ESD类 | 大创面止血闭合夹 | 是 | 202020333322.9 | 自主研发 |
| 7 | ESD类 | 组织牵引固定 | 是 | 201921887702.0 201921270664.4 201921886867.6 | 自主研发 |
| 8 | ERCP类 | 防脱头的导丝 | 是 | 201320146954.4 | 自主研发 |
(2)主要核心技术的具体体现和应用情况
报告期内,唯德康医疗主要核心技术的具体体现和应用情况如下:
| 序号 | 类别 | 核心工艺/技术 | 具体体现 | 应用 产品 |
| 1 | 基础 诊断类 | 支架或导管体内疏通技术 | 通过控制器械的运动,去除支架或导管内部的堵塞物,从而使狭窄或堵塞的管道变通畅,无需更换支架或导管,省时省力,减轻了患者手术的痛苦,且大大减少了患者治疗的成本 | 支架或导管体内疏通装置 |
| 2 | ESD类 | 用齿轮与齿条的配合,控制针尖伸出外管的距离 | 一种内镜用注射针,包括针尖、内管、外管、导向套、针筒、活塞杆和调节组件,针尖、内管和针筒从左向右依次连接,调节组件包括齿轮和齿条,针筒外侧沿轴向设有齿条,针筒内轴向上滑动连接有活塞杆,内管外套设有外管,外管右端与导向套连接,导向套套设于针筒外侧,导向套沿轴向与针筒滑动连接,导向套内设有齿轮,齿轮与齿条配合,齿轮轴向上穿设有转轴,转轴一端穿过导向套侧壁延伸至导向套外侧,转轴与导向套侧壁转动连接,转轴设于导向套外侧的一端上套设有旋钮。本技术提供的一种内镜用注射针,采用齿轮与齿条的配合,控制导向套与针筒的相对位移量,从而控制针尖伸出外管的距离,满足手术的要求,方便快捷,准确率高 | 内镜用注射针 |
2-2-120
| 序号 | 类别 | 核心工艺/技术 | 具体体现 | 应用 产品 |
| 3 | ESD类 | 内镜下切割剥离黏膜下组织 | 一种黏膜切开刀,它包括:外套组件;电圈,所述电圈的头部为类三角形结构,用于剥离黏膜并设置在电圈头部前端的切割电丝以及衔接在切割电丝两侧的支撑丝围成,并且所述支撑丝上套设有绝缘层;滑环,所述滑环设置在外套组件上,并且所述滑环可相对于外套组件轴向移动,滑环上设置有电极插头;拉索,拉索可轴向移动地插装在外套组件内,所述拉索的一端与电圈连接,拉索的另一端与滑环上的电极插头电性连接。本技术不仅在内镜下切割剥离黏膜下组织病灶时,而且切割时推进方便直接,使手术更加方便快捷,大大减少了医生的操作难度,节省了时间 | 黏膜切开刀 |
| 4 | ESD类 | 可分离的钳头架夹持组织 | 一种止血夹,包括夹钳部件、外管部件和推拉部件,夹钳部件具有钳头架和活动夹钳组件,活动夹钳组件安装在钳头架上,推拉部件的一端与活动夹钳组件活动连接,推拉部件的另一端穿过外管部件,外管部件具有固定座、固定套和连接器,连接器的一端可滑动地插装在固定套内,连接器的另一端可滑动地插装在固定座内,钳头架的尾部可滑动地安装在固定套内,连接器的尾部设置有环槽,固定套的尾端设置有与环槽相配合的固定翼,所述的固定翼下压扣接在该连接器上的环槽内,当推拉部件的一端与活动夹钳组件接合时,钳头架的尾端和连接器的前端抵接,当推拉部件的一端与活动夹钳组件分离时,钳头架的尾端和连接器的前端分离 | 止血夹 |
| 5 | ESD类 | 偏心锁紧装置锁紧滑套位置 | 一种一次性使用电圈套器,包括金属丝、管体、手柄和偏心锁紧装置,偏心锁紧装置包括偏心块和滑套,滑套为U形结构,滑套罩设于手柄上端,接线块与U形结构底部固定连接,偏心块转动设置在U形结构两侧壁之间,偏心块设于手柄下端,偏心块转动中心与手柄下端平行,偏心块包括锁紧段和活动段,活动段与偏心块转动中心之间的距离小于手柄下端与偏心块转动中心之间的距离,锁紧段与偏心块转动中心之间的距离大于手柄下端与偏心块转动中心之间的距离。本技术提供的一种一次性使用电圈套器,采用偏心锁紧装置锁紧滑套位置,使金属丝套圈部位置保持稳定,使手术安全可靠,精确切除病变组织 | 一次性使用电圈套器 |
| 6 | ESD类 | 大创面止血闭合 | 通过牵拉夹牵拉病变组织,使病变组织进 | 闭合夹 |
2-2-121
| 序号 | 类别 | 核心工艺/技术 | 具体体现 | 应用 产品 |
| 夹 | 入透明帽,同时释放夹子夹闭组织。释放器可单手操作,且不占用钳道孔,夹子结构简单,进入人体后,不受人体组织蠕动作用的影响,不会产生结构变形和缠绕现象,提高手术的成功率 | |||
| 7 | ESD类 | 组织牵引固定 | 可以对组织进行牵引固定、释放和进行组织拉钩的更换,从而提高手术操作的效率 | 夹壁钩、组织拉钩 |
| 8 | ERCP | 防脱头的导丝 | 在导丝头端安装有弹簧管,增加了芯丝与软头之间的摩擦,提高了软头与芯丝的连接强度,降低了软头脱落的风险,从而有效避免了二次手术,减轻了病人的痛苦,有效地提高手术质量 | 导丝 |
(3)关于“支架或导管体内疏通技术”技术的相关情况
“支架或导管体内疏通技术”系指为了解决放置于人体内支架或导管使用一段时间后会堵塞或变狭窄的问题而发明的一种支架或导管体内疏通技术,从而避免更换支架或导管。基于“支架或导管体内疏通技术”的技术原理,其系源于导丝、及细胞刷、球囊等相关技术的组合。标的公司拥有丰富的导丝及细胞刷专利技术,具体如下:
| 序号 | 专利权人 | 专利名称 | 专利号 | 类型 | 申请日 | 授权公告日 | 取得方式 |
| 一、关于导丝的专利 | |||||||
| 1 | 久虹医疗 | 非血管腔道导丝 | 201320464540.6 | 实用新型 | 2013.07.31 | 2014.01.29 | 原始取得 |
| 2 | 久虹医疗 | 细弯导丝 | 201620638350.5 | 实用新型 | 2016.06.24 | 2017.04.12 | 原始取得 |
| 3 | 久虹医疗 | 非血管腔道导丝 | 201921989491.1 | 实用新型 | 2019.11.18 | 2020.07.28 | 原始取得 |
| 4 | 久虹医疗 | 一种新型亲水涂层导丝 | 202020820775.4 | 实用新型 | 2020.05.15 | 2021.05.14 | 原始取得 |
| 5 | 唯德康医疗 | 一种不易脱头的医用导丝 | 201320146954.4 | 实用新型 | 2013.03.28 | 2013.09.25 | 原始取得 |
| 6 | 唯德康医疗 | 可固定于非血管腔道内的导丝 | 201820871455.4 | 实用新型 | 2018.05.29 | 2019.07.09 | 原始取得 |
| 二、关于球囊导管的相关专利 | |||||||
2-2-122
| 7 | 久虹医疗 | 可快速交换导丝的球囊扩张导管 | 201420311226.9 | 实用新型 | 2014.06.11 | 2014.11.26 | 原始取得 |
| 8 | 久虹医疗 | 带预埋导丝的球囊扩张导管 | 201420308996.8 | 实用新型 | 2014.06.11 | 2014.11.26 | 原始取得 |
| 9 | 久虹医疗 | 三级扩张球囊导管 | 202020793663.4 | 实用新型 | 2020.05.13 | 2021.05.07 | 原始取得 |
| 10 | 唯德康医疗 | 球囊扩张导管 | 201720137238.8 | 实用新型 | 2017.02.15 | 2018.04.03 | 原始取得 |
| 11 | 唯德康医疗 | 头部可弯曲的球囊扩张导管 | 201821598808.4 | 实用新型 | 2018.09.26 | 2019.07.23 | 原始取得 |
| 三、关于细胞刷的专利 | |||||||
| 12 | 久虹医疗 | 记忆弯头可旋转细胞刷 | 202020806594.6 | 实用新型 | 2020.05.14 | 2021.05.07 | 原始取得 |
| 13 | 唯德康医疗 | 双封堵防污染细胞刷 | 201420391664.0 | 实用新型 | 2014.07.15 | 2014.12.03 | 原始取得 |
标的公司判断具备“支架或导管体内疏通技术”的产品具有一定的市场前景,因此积极自主研发并持续加大对该技术领域中的相关技术的研发投入,积极储备相关技术和产品。2019年,标的公司了解到北京航空总医院消化内镜中心张建国医生根据其临床实践,就“支架或导管体内疏通技术”中的一款“支架或导管体内疏通装置”申请了1项发明专利(申请号:201810036134.7)及1项实用新型专利(专利号:201820065605.2),其中发明专利尚未授权。标的公司在了解到张建国医生的初步设想后,认为该初步设想与标的公司已经在研的导丝、球囊导管和细胞刷的相关技术有一定的契合度。标的公司基于未来项目储备及知识产权保护的考虑,向张建国医生提议购买上述专利(即1项发明专利和1项实用新型专利),并付清了转让价款 ;2019年8月5日,上述1项实用新型专利变更登记至标的公司名下,同年8月7日,上述1项发明专利申请人变更为标的公司。
基于目前市场需求等多方面考虑,标的公司暂未将购买取得的“支架或导管体内疏通装置”(专利号为201820065605.2)产品化/商业化;但是,标的公司对与该技术密切相关的技术和产品(如导丝、和细胞刷及球囊)进行持续研发,为未来实现“支架或导管体内疏通装置”的产品化和商业化奠定了基础。
报告期内,标的公司与“支架或导管体内疏通技术”相关的研发项目(导
2-2-123
丝、球囊导管相关项目)及支出具体情况如下:
单位:万元
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 |
| 研发投入 | 81.21 | 119.54 | 253.24 |
2、报告期内核心技术人员变动情况
唯德康医疗建立了一支经验丰富、覆盖研发、生产、质控的核心技术团队,核心技术人员均具有较长从业年限,熟悉各类核心产品的研发与生产流程,具有丰富的技术研发经验。报告期内,唯德康医疗核心技术团队保持稳定,未发生重大变动情况。
(十)主要固定资产、无形资产及特许经营权的情况
1、主要固定资产
唯德康医疗主要固定资产情况详见本节之“六、交易标的主要资产权属、对外担保及主要负债情况”之“(一)主要资产权属情况”之“1、固定资产情况”。
2、主要无形资产
唯德康医疗主要无形资产情况详见本节之“六、交易标的主要资产权属、对外担保及主要负债情况”之“(一)主要资产权属情况”之“2、无形资产情况”。
3、特许经营权情况
截至本报告书签署日,唯德康医疗不存在拥有特许经营权的情况。
(十一)主要业务许可及经营资质
截至本报告书签署日,标的公司及其控股子公司的主要业务许可及资质情况如下:
2-2-124
1、业务许可及资质情况
(1)医疗器械生产备案证
| 序号 | 持证人 | 证书名称 | 证书编号 | 颁发主体 | 备案日期 |
| 1 | 久虹医疗 | 第一类医疗器械生产备案凭证 | 苏常食药监械生产备20153027号 | 常州市市场监督管理局 | 2021.09.22 |
| 2 | 唯德康 医疗 | 第一类医疗器械生产备案凭证 | 苏常食药监械生产备20200055号 | 常州市市场监督管理局 | 2020.12.28 |
(2)医疗器械生产许可证
| 序号 | 持证人 | 证书名称 | 证书编号 | 颁发主体 | 有效期限 |
| 1 | 久虹医疗 | 医疗器械生产许可证 | 苏食药监械生产许20030066号 | 江苏省药品监督管理局 | 2017.06.27-2022.06.26 |
| 2 | 唯德康 医疗 | 医疗器械生产许可证 | 苏食药监械生产许20140033号 | 江苏省药品监督管理局 | 2019.03.21-2024.03.19 |
(3)医疗器械经营备案证
| 序号 | 持证人 | 证书名称 | 证书编号 | 颁发主体 | 备案日期 |
| 1 | 锦福瑞 医疗 | 第二类医疗器械经营备案凭证 | 苏常食药监械经营备20170152号 | 常州市市场监督管理局 | 2021.04.29 |
(4)医疗器械经营许可证
| 序号 | 持证人 | 证书名称 | 证书编号 | 颁发主体 | 有效期至 |
| 1 | 锦福瑞 医疗 | 医疗器械经营许可证 | 苏常食药监械经营许20180004号 | 常州市市场监督管理局 | 2022.11.27 |
标的公司生产经营活动涉及的医疗器械生产许可证和医疗器械经营许可证有效期届满后,标的公司申请续期不存在障碍或重大不确定性。
2、产品备案证或注册证情况
(1)境内医疗器械产品备案证/注册证
截至本报告书签署日,标的公司及其控股子公司拥有的境内医疗器械备案凭证/注册证书47项,其中三类医疗器械注册证书9项,二类医疗器械注册证书34项,一类医疗器械备案凭证4项,具体情况如下:
| 序号 | 持证人 | 注册产品名称 | 注册证号 | 有效期限 |
2-2-125
| 序号 | 持证人 | 注册产品名称 | 注册证号 | 有效期限 |
| 三类医疗器械产品注册证书 | ||||
| 1 | 唯德康医疗 | 一次性使用电圈套器 | 国械注准20163011774 | 2021.03.17-2026.03.16 |
| 2 | 唯德康医疗 | 一次性内镜用注射针 | 国械注准20173151366 | 2017.08.14-2022.08.13 |
| 3 | 唯德康医疗 | 一次性使用止血夹装置 | 国械注准20183080174 | 2018.05.02-2023.05.01 |
| 4 | 唯德康医疗 | 一次性使用括约肌切开刀 | 国械注准20193010815 | 2019.11.01-2024.10.31 |
| 5 | 唯德康医疗 | 一次性使用热活检钳 | 国械注准20193010814 | 2019.11.01-2024.10.31 |
| 6 | 唯德康医疗 | 一次性使用黏膜切开刀 | 国械注准20193010885 | 2019.11.20-2024.11.19 |
| 7 | 唯德康医疗 | 椎体扩张球囊导管 | 国械注准20203040895 | 2020.11.17-2025.11.16 |
| 8 | 唯德康医疗 | 一次性内镜用注射针 | 国械注准20213140724 | 2021.09.13-2026.09.12 |
| 9 | 久虹医疗 | 一次性使用息肉切除器 | 国械注准20173010736 | 2021.05.17-2026.05.16 |
| 二类医疗器械产品注册证书 | ||||
| 10 | 唯德康医疗 | 一次性使用内窥镜给药管 | 苏械注准20172222369 | 2017.12.06-2022.12.05 |
| 11 | 唯德康医疗 | 非血管腔道导丝 | 苏械注准20142020340 | 2019.08.12-2024.08.11 |
| 12 | 唯德康医疗 | 球囊扩张导管 | 苏械注准20142140342 | 2019.08.12-2024.08.11 |
| 13 | 唯德康医疗 | 取石网篮 | 苏械注准20142020341 | 2019.08.12-2024.08.11 |
| 14 | 唯德康医疗 | 取石球囊导管 | 苏械注准20142020364 | 2019.08.12-2024.08.11 |
| 15 | 唯德康医疗 | 一次性使用活体取样钳 | 苏械注准20162020703 | 2021.03.03-2026.03.02 |
| 16 | 唯德康医疗 | 一次性使用胆道引流导管 | 苏械注准20162141482 | 2021.03.19-2026.03.18 |
| 17 | 唯德康医疗 | 一次性使用细胞刷 | 苏械注准20172222010 | 2017.10.27-2022.10.26 |
| 18 | 唯德康医疗 | 一次性使用泌尿道导丝 | 苏械注准20172222011 | 2017.10.27-2022.10.26 |
| 19 | 唯德康医疗 | 椎体成形器械包 | 苏械注准20182041517 | 2018.11.13-2023.11.12 |
| 20 | 唯德康医疗 | 一次性使用取石网篮 | 苏械注准20182021565 | 2018.11.29-2023.11.28 |
| 21 | 唯德康医疗 | 一次性使用输尿管导引鞘 | 苏械注准20182021566 | 2018.11.29-2023.11.28 |
| 22 | 唯德康医疗 | 镍钛合金泌尿系统取石网 | 苏械注准20182021567 | 2018.11.29-2023.11.28 |
| 23 | 唯德康医疗 | 输尿管扩张球囊导管 | 苏械注准20192020219 | 2019.03.05-2024.03.04 |
| 24 | 唯德康医疗 | 一次性使用输尿管支架 | 苏械注准20192140632 | 2019.06.17-2024.06.16 |
| 25 | 唯德康医疗 | 一次性使用内窥镜取石网篮 | 苏械注准20192021574 | 2019.12.25-2024.12.24 |
2-2-126
| 序号 | 持证人 | 注册产品名称 | 注册证号 | 有效期限 |
| 26 | 唯德康医疗 | 内窥镜活检钳 | 苏械注准20192021582 | 2019.12.25-2024.12.24 |
| 27 | 唯德康医疗 | 一次性使用内窥镜用先端帽 | 苏械注准20202061758 | 2020.12.31-2025.12.30 |
| 28 | 唯德康医疗 | 一次性可旋转活检钳 | 苏械注准20212020944 | 2021.06.04-2026.06.03 |
| 29 | 唯德康医疗 | 一次性使用三级球囊扩张导管 | 苏械注准20212020950 | 2021.06.07-2026.06.06 |
| 30 | 唯德康医疗 | 一次性使用无菌取样钳 | 苏械注准20212021056 | 2021.07.12-2026.07.11 |
| 31 | 唯德康医疗 | 一次性使用无菌先端帽 | 苏械注准20212061310 | 2021.09.10-2026.09.09 |
| 32 | 久虹医疗 | 一次性使用活体取样钳 | 苏械注准20152020073 | 2019.10.31-2024.10.30 |
| 33 | 久虹医疗 | 内窥镜用异物钳 | 苏械注准20172221545 | 2017.08.14-2022.08.13 |
| 34 | 久虹医疗 | 一次性使用细胞刷 | 苏械注准20172221297 | 2017.07.03-2022.07.02 |
| 35 | 久虹医疗 | 非血管腔道导丝 | 苏械注准20172221737 | 2017.09.14-2022.09.13 |
| 36 | 久虹医疗 | 一次性使用鳄齿型活体取样钳 | 苏械注准20172221544 | 2017.08.14-2022.08.13 |
| 37 | 久虹医疗 | 一次性使用取石网篮 | 苏械注准20152020220 | 2020.01.23-2025.01.22 |
| 38 | 久虹医疗 | 一次性使用取石球囊 | 苏械注准20152020074 | 2019.10.31-2024.10.30 |
| 39 | 久虹医疗 | 内窥镜用套扎器 | 苏械注准20162021056 | 2021.05.27-2026.05.26 |
| 40 | 久虹医疗 | 食道贲门狭窄扩张器 | 苏械注准20172020647 | 2021.09.15-2026.09.14 |
| 41 | 久虹医疗 | 球囊扩张导管 | 苏械注准20142140317 | 2019.07.01-2024.06.30 |
| 42 | 久虹医疗 | 非血管腔道导丝 | 苏械注准20162021471 | 2021.07.09-2026.07.08 |
| 43 | 久虹医疗 | 一次性使用无菌内窥镜套管 | 苏械注准20212060808 | 2021.04.22-2026.04.21 |
| 一类医疗器械产品备案 | ||||
| 44 | 唯德康医疗 | 医用导管夹 | 苏常械备20200378号 | 2020.12.16-长期有效 |
| 45 | 唯德康医疗 | 组织固定液 | 苏常械备20200309号 | 2020.10.09-长期有效 |
| 46 | 久虹医疗 | 医用手持式球囊压力泵 | 苏常械备20160151号 | 2016.08.01-长期有效 |
| 47 | 久虹医疗 | 口垫 | 苏常械备20153174号 | 2015.09.10-长期有效 |
1)境内第II类和第III类医疗器械产品收入及利润贡献根据唯德康医疗和久虹医疗的医疗器械产品销售收入情况、医疗器械注册证书,标的资产拥有的境内第II类和第III类医疗器械产品(剔除口罩)报告期内收入、利润贡献及占报告期内境内销售业务的比重情况如下:
2-2-127
单位:万元
| 项目 | 2021年1-6月 | |||
| 销售收入 | 占比(%) | 利润贡献 | 占比(%) | |
| 第Ⅱ类 | 6,970.55 | 54.92 | 2,365.17 | 57.20 |
| 第Ⅲ类 | 5,309.59 | 41.84 | 1,623.81 | 39.27 |
| 口罩 | 3.75 | 0.03 | -1.19 | -0.03 |
| 其他 | 407.56 | 3.21 | 147.14 | 3.56 |
| 小计 | 12,691.45 | 100.00 | 4,134.93 | 100.00 |
| 项目 | 2020年度 | |||
| 销售收入 | 占比(%) | 利润贡献 | 占比(%) | |
| 第Ⅱ类 | 11,331.27 | 48.53 | 3,741.62 | 52.33 |
| 第Ⅲ类 | 7,289.07 | 31.22 | 2,236.34 | 31.28 |
| 口罩 | 4,206.74 | 18.02 | 1,005.40 | 14.06 |
| 其他 | 522.87 | 2.24 | 166.84 | 2.33 |
| 小计 | 23,349.94 | 100.00 | 7,150.21 | 100.00 |
| 项目 | 2019年度 | |||
| 销售收入 | 占比(%) | 利润贡献 | 占比(%) | |
| 第Ⅱ类 | 10,841.69 | 69.17 | 3,348.38 | 70.96 |
| 第Ⅲ类 | 4,301.18 | 27.44 | 1,225.54 | 25.97 |
| 其他 | 531.15 | 3.39 | 144.64 | 3.07 |
| 小计 | 15,674.02 | 100.00 | 4,718.55 | 100.00 |
注:标的公司未按照产品进行会计分部核算,利润贡献为按照产品毛利分摊期间费用后的营业利润
报告期内,标的公司第三类医疗器械产品销售收入分别为4,301.18万元、7,289.07万元及5,309.59万元,对应利润贡献分别为1,225.54万元、2,236.34万元及1,623.81万元,标的公司第三类医疗器械产品收入及利润贡献占比逐步上升。根据唯德康医疗和久虹医疗的医疗器械注册证书,标的资产拥有的境内第II类和第III类医疗器械产品均已取得全部必须的医疗器械产品注册证。2)标的资产第Ⅲ类医疗器械产品的竞争优势根据《治理高值医用耗材改革方案》的相关规定,明确“加强高值医用耗
2-2-128
材规范化管理,明确治理范围,将单价和资源消耗占比相对较高的高值医用耗材作为重点治理对象”。其中“对于临床用量较大、采购金额较高、临床使用较成熟、多家企业生产的高值医用耗材,按类别探索集中采购,鼓励医疗机构联合开展带量谈判采购,积极探索跨省联盟采购。”从目前开展带量采购的产品种类来看,冠脉球囊、人工晶体、骨科关节、心脏起搏器、吻合器等心血管介入、骨科、眼科三大领域的高值耗材被采购次数最多。
根据《医疗器械监督管理条例》的相关规定,国家对医疗器械按照风险程度实行分类管理。其中第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械;第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械;第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素。报告期内,标的公司第Ⅲ类医疗器械产品具体情况如下:
| 序号 | 产品分类 | 主要产品 | 竞争优势 |
| 1 | 金属支架类 | 肠道支架、胆道支架、覆膜食道支架 | 标的公司代理产品,用于丰富标的公司消化内镜诊疗领域产品线 |
| 2 | 基础诊断类 | 一次性使用电圈套器、一次性使用息肉切除器 | 临床友好度高,产品实现同步旋转,更好贴合病灶 |
| 3 | ESD类产品 | 一次性内镜用注射针、一次性使用黏膜切开刀、一次性使用热活检钳、硬化剂注射针 | 规格众多,有效满足临床需求;创新工艺设计,临床友好度高,有效减少临床创伤 |
| 4 | ERCP类产品 | 一次性使用括约肌切开刀 | 创新工艺设计,临床友好度高,有效减少临床创伤 |
| 5 | 止血闭合类 | 一次性使用止血夹装置 | 一体化设计,无需安装;反复开合,定位精准 |
如上表所示,金属支架类产品系标的公司代理品牌产品,如后续纳入“带量采购”清单,标的公司作为其境内代理商可以将一部分降价风险转移至生产厂商,亦可选择不再继续代理;基础诊断类产品中,一次性使用电圈套器及一
2-2-129
次性使用息肉切除器于2021年9月23日纳入浙江省第二批医用耗材集中带量采购清单,目前尚处于申报阶段,报告期内上述两项产品在浙江省销售收入占同期营业收入比例较低;ESD类及ERCP类产品用于进行消化内镜手术中较为复杂的“内镜下黏膜剥离术(ESD)”及“内镜逆行胆胰管造影术(ERCP)”。由于ESD手术及ERCP手术在我国尚处于发展初期,临床应用尚未达到成熟状态,且ESD类产品及ERCP类产品占用终端医院采购金额较低,目前尚未被纳入集采目录,未来是否存在纳入集采的可能,将取决于ESD手术及ERCP手术在临床中的推广情况及其对临床资源的占用情况;止血闭合类产品中,一次性使用止血夹装置临床使用量较大,但产品单价较低,终端医疗机构采购金额较低,如后续拟纳入“带量采购”清单,预计降价幅度有限,与此同时标的公司预期销量亦将有所上升。3)已进入注册认证程序的产品情况截至本报告书签署日,标的公司已进入注册认证程序的产品情况如下:
| 序号 | 申请人 | 注册产品名称 | 注册类型 | 目前进度 |
| 1 | 唯德康医疗 | 高频止血钳 | 首次注册 | 审评中 |
| 2 | 唯德康医疗 | 一次性内镜用注射针 | 延续注册 | 审评中 |
| 3 | 久虹医疗 | 内窥镜用异物钳 | 延续注册 | 审评中 |
| 4 | 久虹医疗 | 一次性使用细胞刷 | 延续注册 | 审评中 |
| 5 | 久虹医疗 | 非血管腔道导丝 | 延续注册 | 审评中 |
| 6 | 久虹医疗 | 一次性使用鳄齿型活体取样钳 | 延续注册 | 审评中 |
(2)境外医疗器械产品注册证
截至本报告书签署日,标的公司及其控股子公司拥有欧盟CE注册证书、英国产品注册证书、美国FDA注册证书、加拿大产品注册证书、沙特产品注册证书、巴西产品注册证书、印度尼西亚产品注册证书等境外医疗器械产品注册证,具体情况如下:
2-2-130
①欧盟CE认证
截至本报告书签署日,唯德康医疗及其控股子公司拥有的欧盟CE注册证情况如下:
| 序号 | 持证人 | 产品名称 | 产品 类别 | 证书编号 | 证书签发机构 | 有效期至 |
| 1 | 唯德康医疗 | Disposable Polyp Snares | Ⅱb | HD601410760001 | T?V Rheinland LGA Products GmbH | 2024.05.27 |
| 2 | 唯德康医疗 | Injection Needles | Ⅱa | |||
| 3 | 唯德康医疗 | Disposable Non-electric Biopsy Forceps | Ⅱa | |||
| 4 | 唯德康医疗 | Gastrointestinal and Biliary Balloon Catheters | Ⅱa | |||
| 5 | 唯德康医疗 | Stone Extraction Baskets | Ⅱa | |||
| 6 | 唯德康医疗 | Stone Extraction Balloons | Ⅱa | |||
| 7 | 唯德康医疗 | Non-vascular Guidewires | Ⅱa | |||
| 8 | 唯德康医疗 | Disposable Nasal Biliary Drainage Tubes | Ⅱa | |||
| 9 | 唯德康医疗 | Disposable Spray Catheters | Ⅰs | |||
| 10 | 唯德康医疗 | Disposable Endoscopic Hemoclips | Ⅱb | |||
| 11 | 唯德康医疗 | Disposable Cytology Brushes | Ⅱa | |||
| 12 | 唯德康医疗 | Disposable Bougie Dilators | Ⅱa | |||
| 13 | 唯德康医疗 | Disposable Hot Biopsy Forceps | Ⅱb | |||
| 14 | 唯德康医疗 | Balloon Inflators | Ⅰs | |||
| 15 | 唯德康医疗 | Disposable Grasping Forceps | Ⅱa | |||
| 16 | 唯德康医疗 | Kyphoplasty Balloon Catheters | Ⅱa | |||
| 17 | 唯德康医疗 | Disposable Cold Snares | Ⅱa | |||
| 18 | 唯德康医疗 | Disposable Bite Blocks | Ⅰs | |||
| 19 | 唯德康医疗 | Biopsy Valve | Ⅰs |
2-2-131
| 序号 | 持证人 | 产品名称 | 产品 类别 | 证书编号 | 证书签发机构 | 有效期至 |
| 20 | 唯德康医疗 | Polyp Traps | Ⅰs | |||
| 21 | 唯德康医疗 | Cleaning Brushes for Endoscope | Ⅰs | |||
| 22 | 唯德康医疗 | Cleaning Brushes for Endoscope | I (non-sterile) | - | - | - |
| 23 | 唯德康医疗 | Biopsy Valves | - | - | - | |
| 24 | 久虹医疗 | Biopsy Valves | I (non-sterile) | - | - | - |
| 25 | 久虹医疗 | Cleaning Brushes for Endoscope | - | - | - | |
| 26 | 久虹医疗 | Gastrointestinal and Biliary Balloon Catheters | IIa | HD 2029448-1 | T?V Rheinland LGA Products GmbH | 2024.05.26 |
| 27 | 久虹医疗 | Stone Extraction Baskets | IIa | |||
| 28 | 久虹医疗 | Stone Extraction Balloons | IIa | |||
| 29 | 久虹医疗 | Non-vascular Guidewires | IIa | |||
| 30 | 久虹医疗 | Polyp Snares | IIb | |||
| 31 | 久虹医疗 | Injection Needles | IIa | |||
| 32 | 久虹医疗 | Disposable Endoscopic Hemoclips | IIb | |||
| 33 | 久虹医疗 | Kyphoplasty Balloon Catheters | IIa | |||
| 34 | 久虹医疗 | Disposable Non-electric Biopsy Forceps | IIa | |||
| 35 | 久虹医疗 | Grasping Forceps | IIa | |||
| 36 | 久虹医疗 | Disposable Cytology Brushes | IIa | |||
| 37 | 久虹医疗 | Disposable Electric Biopsy Forceps | IIb | |||
| 38 | 久虹医疗 | Cleaning Brushes for Endoscope | Is | |||
| 39 | 久虹医疗 | Disposable Bite Blocks | Is | |||
| 40 | 久虹医疗 | Biopsy Valve | Is | |||
| 41 | 久虹医疗 | Balloon Inflators | Is |
2-2-132
| 序号 | 持证人 | 产品名称 | 产品 类别 | 证书编号 | 证书签发机构 | 有效期至 |
| 42 | 久虹医疗 | Polyp Traps | Is | |||
| 43 | 久虹医疗 | Balloon Kyphoplasty Kits | IIa | |||
| 44 | 久虹医疗 | Multiple Band Ligators | IIa | |||
| 45 | 久虹医疗 | Bougie Dilator Sets | Is |
注:第22、23、24、25项产品根据欧盟MDR(2017/745)法规,属于一类非灭菌、非测量、非可重复使用的产品,无需通过公告机构进行MDR注册,仅需进行备案。第22项产品备案日期为2020年9月14日,第23项产品备案日期为2021年5月28日,第24项产品备案日期为2021年6月30日,第25项产品备案日期为2021年7月22日,上述4项产品备案无有效期
②英国产品注册
截至本报告书签署日,标的公司及其控股子公司的产品在英国注册情况如下:
| 序号 | 持证人 | 产品代码 | 类别 | 注册证号 | 有效期限 |
| 1 | 久虹医疗 | Endoscopic biopsy valve, single-use | I (sterile) | 0000014932 | 2021.05.26-2023.06.30 |
| 2 | 久虹医疗 | Surgical suction system collection container, single-use | I (sterile) | ||
| 3 | 久虹医疗 | Flexible endoscopic tissue manipulation forceps, single-use | IIa | ||
| 4 | 久虹医疗 | General-purpose endoscopic needle, single-use | IIa | ||
| 5 | 久虹医疗 | Gastrointestinal endoscopic clip, long-term, non-bioabsorbable | IIb | ||
| 6 | 唯德康医疗 | Mechanical-cutting endoscopic polypectomy snare | IIa | 0000016714 | 2021.08.11-2023.06.30 |
| 7 | 唯德康医疗 | Flexible endoscopic tissue manipulation forceps, single-use | IIa | ||
| 8 | 唯德康医疗 | Flexible endoscopic biopsy forceps, single-use | IIb |
2-2-133
| 9 | 唯德康医疗 | Gastrointestinal/biliary dilation balloon catheter | IIb |
| 10 | 唯德康医疗 | General-purpose endoscopic needle, single-use | IIa |
| 11 | 唯德康医疗 | Gastro-urological guidewire, single-use | I (sterile) |
| 12 | 唯德康医疗 | ERCP catheter, balloon, non-electrical, stone-retrieval | IIa |
| 13 | 唯德康医疗 | Biliary/urinary stone retrieval basket, single-use | IIa |
| 14 | 唯德康医疗 | Gastrointestinal endoscopic clip, long-term, non-bioabsorbable | IIa |
| 15 | 唯德康医疗 | Endoscopic spray catheter, single-use | IIa |
| 16 | 唯德康医疗 | Endoscopic electrosurgical handpiece/electrode, monopolar, single-use | IIa |
注:根据英国药物健康监管局(“MHRA”)发布的《指南》(Guidance),截至2023年6月30日,英国市场(英格兰、威尔士、苏格兰)仍认可欧盟CE认证;自2023年7月1日起,任何在英国市场销售的医疗器械产品都需使用UKCA(UK Conformity Assessed)标识。所有进入英国市场的医疗器械产品自2021年1月1日起,可在不同的宽限期内进行MHRA注册,目前久虹医疗和唯德康医疗均已经完成MHRA注册
根据英国药物健康监管局(“MHRA”)发布的《指南》(Guidance RegulatingMedical Devices in the UK),截至2023年6月30日,英国市场(英格兰、威尔士、苏格兰)仍认可欧盟CE认证;自2023年7月1日起,任何在英国市场销售的医疗器械产品均须使用UKCA(UK Conformity Assessed)标识;自2021年1月1日起,任何在英国市场销售的医疗器械产品均须在英国药物健康监管局注册(“MHRA注册”)。报告期内,标的公司于英国实现的销售收入金额较小,分别为49.21万元、75.13万元及20.33万元。因此标的公司未就CE认证下的所有产品全部进行MHRA注册,仅就历史年度已在英国实现销售的产品及未来拟进入英国市场的产品进行MHRA注册。A、唯德康医疗的MHRA注册的具体进展截至本报告书签署日,唯德康医疗拟对13款产品进行MHRA注册,其中11
2-2-134
款产品已完成MHRA注册,还有2款产品处于注册阶段,具体情况如下:
| 序号 | 产品名称 | 类别 | 注册证号 | 有效期限 |
| 1 | Disposable Non-electric Biopsy Forceps | IIa | 0000016714 | 2021.08.11-2023.06.30 |
| 2 | Injection Needles | IIa | ||
| 3 | Disposable Endoscopic Hemoclips | IIb | ||
| 4 | Disposable Polyp Snares | IIb | ||
| 5 | Disposable Grasping Forceps | IIa | ||
| 6 | Disposable Spray Catheters | I(sterile) | ||
| 7 | Disposable Cold Snares | IIa | ||
| 8 | Gastrointestinal and Biliary Balloon Catheters | IIa | ||
| 9 | Stone Extraction Baskets | IIa | ||
| 10 | Stone Extraction Balloons | IIa | ||
| 11 | Non-vascular Guidewires | IIa |
唯德康医疗已就以下2项产品启动向MHRA申请注册的程序:
| 序号 | 申请人 | 产品名称 | 类别 |
| 1 | 唯德康医疗 | Disposable Cytology Brush | IIa |
| 2 | 唯德康医疗 | Disposable Bite Block | I (sterile) |
B、法定宽限期,是否存在不能如期办毕风险,如不能如期办毕对标的资产境外销售业务的具体影响
2-2-135
a)法定宽限期根据《指南》,所有已投放英国市场销售的医疗器械产品自2021年1月1日起,可在不同的宽限期内进行MHRA注册,具体如下:III类和IIb类植入物、所有有源植入式器械以及列于清单A的体外诊断器械为4个月(至2021年5月1日);其他IIb类器械、所有IIa类器械、列于清单B的体外诊断器械以及自检体外诊断器械为8个月(至2021年9月1日);I类器械、定制器械以及通用体外诊断器械为12个月(至2022年1月1日)。根据《指南》,若未能在上述宽限期届满前完成已投放英国市场产品的MHRA注册,宽限期届满后将不能在英国市场上合法销售该等医疗器械产品;宽限期届满后,仍可对未投放英国市场销售的产品进行MHRA注册,但相关产品注册完成前不能在英国市场销售。
b)如不能如期办毕对标的资产境外销售业务的具体影响截至本报告书签署日,标的公司已在英国市场销售的产品、该等产品的法定宽限期、MHRA注册的情况如下:
2-2-136
| 序号 | 原销售方 | 产品名称 | 类别 | 宽限期截点 | 现注册主体 | 是否完成MHRA注册 |
| 1 | 唯德康医疗 | Disposable Endoscopic Hemoclips | IIb | 2021.09.01 | 唯德康医疗 | 是 |
| 2 | 唯德康医疗 | Disposable Cold Snares | IIa | 2021.09.01 | 唯德康医疗 | 是 |
| 3 | 唯德康医疗 | Disposable Spray Catheters | I (sterile) | 2022.01.01 | 唯德康医疗 | 是 |
| 4 | 久虹医疗 | Disposable Polyp Snares | IIb | 2021.09.01 | 唯德康医疗 | 是 |
| 5 | 久虹医疗 | Disposable Bite Block | I (sterile) | 2022.01.01 | 唯德康医疗 | 注册中 |
| 6 | 久虹医疗 | Biopsy Valve | I (sterile) | 2022.01.01 | 唯德康医疗 | 是 |
| 7 | 久虹医疗 | Polyp Trap | I (sterile) | 2022.01.01 | 唯德康医疗 | 是 |
| 8 | 久虹医疗 | Disposable Endoscopic Hemoclips | IIb | 2021.09.01 | 唯德康医疗 | 是 |
| 9 | 久虹医疗 | Disposable Non-electric Biopsy Forceps | IIa | 2021.09.01 | 唯德康医疗 | 是 |
| 10 | 久虹医疗 | Disposable Grasping Forcepts | IIa | 2021.09.01 | 久虹医疗 | 是 |
如上表所述,标的公司已在英国市场实现销售的产品中除“DisposableBite Block”一款产品尚处于注册阶段外,其余产品均完成注册。该产品宽限期至2022年1月1日,预计在该宽限期内,该产品能够完成注册。此外,唯德康医疗曾于IIa类产品宽限期(2021年9月1日)届满前向客户以样品形式销售少量Disposable Cytology Brush(IIa类)产品,用于客户进行产品检验,该产品尚未投放英国市场销售,无需取得MHRA注册证。鉴于客户对该产品检验结果较为满意,标的公司拟将其投放英国市场销售,因此唯德康医疗已就Disposable Cytology Brush启动向MHRA申请注册的程序,完成注册不存在实质性法律障碍。
综上,唯德康医疗的MHRA注册程序不存在如期办理完毕的实质性障碍。
③美国FDA注册
截至本报告书签署日,标的公司及其控股子公司产品的FDA注册情况如下:
2-2-137
| 序号 | 持证人 | 产品名称 | 类别 | 510K号 | 批准时间 |
| 1 | 唯德康医疗 | Disposable Biopsy Forceps | Ⅰ | 豁免 | - |
| 2 | 唯德康医疗 | Non-vascular Guidewires | Ⅱ | 豁免 | - |
| 3 | 唯德康医疗 | Spray Catheters | Ⅰ | 豁免 | - |
| 4 | 唯德康医疗 | Dilation Balloons | Ⅱ | 豁免 | - |
| 5 | 唯德康医疗 | Balloon Inflators | Ⅱ | 豁免 | - |
| 6 | 唯德康医疗 | Disposable Bite Block | Ⅰ | 豁免 | - |
| 7 | 唯德康医疗 | Disposable Cleaning Brush | Ⅰ | 豁免 | - |
| 8 | 唯德康医疗 | Disposable Cold Snares | Ⅰ | 豁免 | - |
| 9 | 唯德康医疗 | Disposable Grasping Forceps | Ⅱ | 豁免 | - |
| 10 | 久虹医疗 | Forceps, Biopsy, Non-electric | I | 豁免 | - |
| 11 | 久虹医疗 | Bite Block | I | 豁免 | - |
| 12 | 久虹医疗 | Polyp Traps | II | 豁免 | - |
| 13 | 久虹医疗 | Cleaning Brushes for Endoscope | I | 豁免 | - |
| 14 | 久虹医疗 | Dilation Balloons | II | 豁免 | - |
| 15 | 久虹医疗 | Non-vascular Guidewires | II | 豁免 | - |
| 16 | 久虹医疗 | Balloon Inflators | II | 豁免 | - |
| 17 | 久虹医疗 | Disposable Grasping Forceps | II | 豁免 | - |
| 18 | 久虹医疗 | Bougie Dilator Sets | II | 豁免 | - |
注:按照相关法律,美国FDA市场准入的常规途径一般有三种:510k豁免、PremarketNotification(PMN)即510k、上市前许可(PMA),唯德康医疗及其控股子公司目前拥有510k豁免注册途径,这种途径无有效期,需要每年进行年度注册;唯德康医疗及其控股子公司已通过2021年年度注册
④加拿大产品注册
截至本报告书签署日,标的公司及其控股子公司的产品在加拿大的注册情况如下:
| 序号 | 持证人 | 产品名称 | 类别 | 注册证号 | 获证时间 |
| 1 | 唯德康医疗 | Injection Needles | Ⅱ | 104954 | 2020.07.24 |
| 2 | 唯德康医疗 | Disposable Grasping Forceps | Ⅱ | 104950 | 2020.07.24 |
| 3 | 唯德康医疗 | Disposable Polyp Snares | Ⅱ | 104984 | 2020.07.30 |
| 4 | 唯德康医疗 | Disposable Endoscopic Hemoclips | Ⅱ | 105021 | 2020.08.12 |
| 5 | 唯德康医疗 | Disposable Non-electric Biopsy Forceps | Ⅱ | 105022 | 2020.08.12 |
2-2-138
| 序号 | 持证人 | 产品名称 | 类别 | 注册证号 | 获证时间 |
| 6 | 唯德康医疗 | Disposable Cold Snares (Ptfe) | Ⅱ | 105135 | 2020.09.11 |
| 7 | 唯德康医疗 | Polyp Trap | Ⅰ | 14963 | 2020.10.28 |
| 8 | 唯德康医疗 | Disposable Cytology Brushes | Ⅱ | 105854 | 2021.02.15 |
| 9 | 唯德康医疗 | Disposable Spray Catheters | Ⅱ | 105855 | 2021.02.15 |
| 10 | 久虹医疗 | Disposable Grasping Forceps | II | 99750 | 2017.09.29 |
| 11 | 久虹医疗 | Disposable Endoscopic Hemoclips | II | 102257 | 2019.01.14 |
| 12 | 久虹医疗 | Injection Needles | II | 102578 | 2019.03.15 |
| 13 | 久虹医疗 | Disposable Polypectomy Snares | II | 81389 | 2009.12.07 |
| 14 | 久虹医疗 | Disposable Biopsy Forceps | II | 79622 | 2009.04.24 |
注:依据相关法律,在加拿大,I类产品进入市场需要进行医疗器械企业登记证(MedicalDevice Establishment License),II、III和IV类产品市场需要获得医疗器械许可证(MedicalDevice License)。唯德康医疗及其控股子公司目前有I和II类产品,存在医疗器械企业登记证和医疗器械许可证两种途径,这两种途径无有效期,需要每年进行续费;唯德康医疗及其控股子公司的上述产品注册证已进行2021年续费
⑤沙特产品注册
截至本报告书签署日,标的公司及其控股子公司产品在沙特的注册情况如下:
| 序号 | 持证人 | 产品名称 | 注册证号 | 获证日期 | 有效期至 |
| 1 | Medical Regulations Gate LLC | Disposable Non-electric Biopsy Forceps | GHTF-2020-1106 | 2020.05.12 | 2023.05.12 |
| 2 | Medical Regulations Gate LLC | Disposable Polyp Snares | GHTF-2020-1128 | 2020.05.13 | 2023.05.13 |
| 3 | Medical Regulations Gate LLC | Injection Needles | GHTF-2020-1177 | 2020.05.17 | 2023.05.17 |
| 4 | Medical Regulations Gate LLC | Disposable Endoscopic Hemoclips | GHTF-2020-1191 | 2020.05.18 | 2023.05.18 |
| 5 | Medical Regulations Gate LLC | Disposable Bite Block | GHTF-2021-0583 | 2021.04.16 | 2024.04.16 |
| 6 | Medical Regulations Gate LLC | Polyp Trap | GHTF-2021-0591 | 2021.04.16 | 2024.04.16 |
| 7 | Medical Regulations Gate LLC | Disposable Spray Catheter | GHTF-2021-0581 | 2021.04.16 | 2024.04.16 |
2-2-139
| 序号 | 持证人 | 产品名称 | 注册证号 | 获证日期 | 有效期至 |
| 8 | Medical Regulations Gate LLC | Non-vascular Guidewire | GHTF-2021-0595 | 2021.04.17 | 2024.04.17 |
| 9 | Medical Regulations Gate LLC | Disposable Grasping Forceps | GHTF-2021-0604 | 2021.04.18 | 2024.04.18 |
| 10 | Medical Regulations Gate LLC | Disposable Cold Snare | GHTF-2021-0624 | 2021.04.24 | 2024.04.24 |
| 11 | Medical Regulations Gate LLC | Stone Extraction Balloon | GHTF-2021-0741 | 2021.05.31 | 2024.05.27 |
注:境外制造商在沙特申请注册医疗器械前,需要在沙特境内委托一个授权代表负责注册程序,完成注册后获得市场准入证书。Medical Regulations Gate LLC.为唯德康医疗授权的持证人
⑥巴西产品注册
截至本报告书签署日,标的公司及其控股子公司产品在巴西的注册情况如下:
| 序号 | 持证人 | 产品名称 | 类别 | 注册证号 | 获证日期 |
| 1 | VR MEDICAL IMPORTADORA | Bal?o de Dilata??o | Ⅱ | 80102519076 | 2020.11.26 |
| 2 | VR MEDICAL IMPORTADORA | Pin?a de Biópsia N?o Elétrica Descartável | Ⅱ | 80102519077 | 2020.11.26 |
| 3 | VR MEDICAL IMPORTADORA | Agulha de Inje??o | Ⅱ | 80102519078 | 2020.11.26 |
| 4 | VR MEDICAL IMPORTADORA | Cesto de Extra??o de Cálculos | Ⅱ | 80102519094 | 2021.05.21 |
| 5 | VR MEDICAL IMPORTADORA | Fio Guia N?o Vascular | Ⅱ | 80102519098 | 2021.06.10 |
| 6 | VR MEDICAL IMPORTADORA | Bal?o de Extra??o de Cálculos | Ⅱ | 80102519100 | 2021.06.18 |
| 7 | VR MEDICAL IMPORTADORA | Pin?a de Corpo Estranho Descartável | Ⅱ | 80102519104 | 2021.07.15 |
注:境外制造商在巴西申请注册医疗器械前,需要委派一个获得巴西卫生监管局(ANVISA)认证许可的在巴西注册的持有人(BRH)负责注册申请,并提供注册文档递交注册,审核通过后即可上市,注册证无有效期。VR MEDICAL IMPORTADOR是获得ANVISA认证许可的持有人(其非经销商),为唯德康医疗授权的持证人
⑦印度尼西亚产品注册
截至本报告书签署日,标的公司及其控股子公司产品在印度尼西亚的注册情况如下:
| 序号 | 持证人 | 产品名称 | 类别 | 注册证号 | 获证时间 | 有效期至 |
2-2-140
| 序号 | 持证人 | 产品名称 | 类别 | 注册证号 | 获证时间 | 有效期至 |
| 1 | PT. TRITRA PRIMA | Disposable Non-electric Biopsy Forceps | A | 10804024194 | 2020.07.28 | 2025.03.10 |
| 2 | PT. TRITRA PRIMA | Injection Needles | B | 20801024794 | 2020.08.27 | 2025.03.10 |
| 3 | PT. TRITRA PRIMA | Disposable Spray Catheters | B | 20801024836 | 2020.08.28 | 2025.03.10 |
| 4 | PT. TRITRA PRIMA | Stone Extraction Baskets | B | 20801026287 | 2020.10.20 | 2025.03.10 |
| 5 | PT. TRITRA PRIMA | Gastrointestinal and Biliary Balloon Catheters | B | 20801026468 | 2020.10.27 | 2025.03.10 |
| 6 | PT. TRITRA PRIMA | Non-vascular Guidewires | B | 20801026467 | 2020.10.27 | 2025.03.10 |
| 7 | PT. TRITRA PRIMA | Disposable Endoscopic Hemoclips | C | 20804027261 | 2020.11.29 | 2025.03.10 |
| 8 | PT. TRITRA PRIMA | Disposable Polyp Snares | C | 20804027260 | 2020.11.29 | 2025.03.10 |
| 9 | PT. TRITRA PRIMA | Stone Extraction Balloons | C | 20805120070 | 2021.01.07 | 2025.03.10 |
注:境外制造商在印尼申请注册医疗器械前,需要委派一个在当地有经销许可资质的法人实体作为授权代表负责注册申请,并提供注册文档递交注册,审核通过后即可上市。PT.TRITRA PRIMA为唯德康医疗的授权持证人
3、质量体系认证情况
截至本报告书签署日,标的公司及其控股子公司的质量体系认证情况如下:
| 序号 | 持有主体/制造商 | 认证标准 | 证书编号 | 认证机构 | 有效期限 |
| 1 | 唯德康医疗 | MDSAP ISO13485:2016 | MD 244285760-200 | T?V Rheinland of North America,Inc | 2021.01.28- 2021.11.09 |
| 2 | 久虹医疗 | MD 244336837-30 | 2021.09.18- 2024.09.17 | ||
| 3 | 唯德康医疗 | EN ISO 13485:2016 | SX 60149689 0001 | T?V Rheinland LGA Products GmbH | 2020.08.19- 2023.08.18 |
| 4 | 久虹医疗 | SX 2029448-1 | 2021.05.21- 2023.07.08 | ||
| 5 | 唯德康医疗 | 韩国KGMP认证 | KCL-BBAA-10083 | MFDS | 2021.07.17- 2024.07.16 |
| 6 | 唯德康医疗 | KCL-BAAA-9898 | 2020.12.09- 2023.12.08 | ||
| 7 | 唯德康医疗 | KCL-ABAA-9779 | 2021.01.25- 2024.01.24 |
2-2-141
| 序号 | 持有主体/制造商 | 认证标准 | 证书编号 | 认证机构 | 有效期限 |
| 8 | 久虹医疗 | KTR-ABAA-12075 | 2021.08.24- 2024.08.23 | ||
| 9 | 久虹医疗 | KTL-BBAA-8156 | 2020.05.08- 2023.05.07 | ||
| 10 | 久虹医疗 | KCL-BAAA-11524 | 2021.06.21- 2024.06.20 | ||
| 11 | 久虹医疗 | KCL-BBAA-12249 | 2021.09.17- 2024.09.16 | ||
| 12 | 久虹医疗 | KCL-BBAA-12344 | 2021.10.05-2024.10.04 | ||
| 13 | 唯德康医疗 | 台湾GMP认证 | 卫授食字第1096028793号 | 台湾卫生福利部 | 至2024.08.26 |
注:第1-4项为标的公司独立持证
原3项已到期及2项即将到期的质量体系认证均系久虹医疗拥有,前述质量体系认证的办理程序情况及对生产经营的具体影响情况如下:
| 序号 | 制造商 | 认证标准 | 证书编号 | 认证机构 | 有效期限 | 持证主体 | 续期证书编号 | 续期有效期限 | 续期手续办理情况 | 对生产经营的具体影响 |
| 1 | 久虹医疗 | MDSAP | MD 387836 244 168038-30 | T?V | 2020.05.07-2021.09.17 | 久虹医疗 | MD 244336837-30 | 2021.09.18-2024.09.17 | 办理完毕 | / |
| 2 | 久虹医疗 | 韩国KGMP | KTR-ABB-2366 | MFDS | 2018.08.05-2021.08.04 | BCM Co., Ltd. | KTR-ABAA-12075 | 2021.08.24-2024.08.23 | 办理完毕 | / |
| 3 | 久虹医疗 | KCL-BBAAE-10036 | 2020.12.23-2021.09.26 | M.I. Tech Co., Ltd. | / | / | 不再续期 | 标的公司自主决策,后续由唯德康医疗持续承担M.I. Tech Co., Ltd.相关生产制造工作,因此该证书不再续期,对标的公司生产 |
2-2-142
| 序号 | 制造商 | 认证标准 | 证书编号 | 认证机构 | 有效期限 | 持证主体 | 续期证书编号 | 续期有效期限 | 续期手续办理情况 | 对生产经营的具体影响 |
| 经营无不利影响 | ||||||||||
| 4 | 久虹医疗 | KCL-BBA-3453 | 2018.10.11-2021.08.04 | MEDISWEEP Co., Ltd. | KCL-BBA-12249 | 2021.09.17-2024.09.16 | 办理完毕 | / | ||
| 5 | 久虹医疗 | KTC-BBA-4004 | 2018.12.06-2021.08.04 | Ginwon Medical Co., Ltd. | KCL-BBAA-12344 | 2021.10.05-2024.10.04 | 办理完毕 | / |
4、进出口业务许可情况
截至本报告书签署日,标的公司及其控股子公司进出口业务许可情况如下:
| 序号 | 持有主体 | 证书名称 | 证书编号 | 颁发主体 | 有效期限 |
| 1 | 唯德康医疗 | 中华人民共和国海关报关单位注册登记证书 | 3204963P22 | 常州海关驻武进办事处 | 2015.08.18-长期 |
| 2 | 久虹医疗 | 中华人民共和国海关报关单位注册登记证书 | 3204968124 | 常州海关驻武进办事处 | 2016.08.30-长期 |
| 3 | 锦福瑞医疗 | 海关进出口货物收发货人备案回执 | 3204968B17 | 常州海关驻武进办事处 | 2020.09.15-长期 |
| 4 | 唯德康医疗 | 对外贸易经营者备案登记表 | 02242207 | - | 2016.11.07-长期 |
| 5 | 久虹医疗 | 对外贸易经营者备案登记表 | 02242381 | - | 2016.12.20-长期 |
| 6 | 锦福瑞医疗 | 对外贸易经营者备案登记表 | 04086040 | - | 2020.08.26-长期 |
5、高新技术企业证书
截至本报告书签署日,标的公司及其控股子公司获得的高新技术企业证书情况如下:
2-2-143
| 序号 | 持有 主体 | 证书名称 | 证书编号 | 颁发主体 | 有效期限 |
| 1 | 唯德康医疗 | 高新技术企业证书 | GR201832008184 | 江苏省科学技术厅、江苏省财政厅、国家税务总局江苏省税务局 | 2018.12.03-2021.12.02 |
| 2 | 久虹 医疗 | 高新技术企业证书 | GR201832001963 | 江苏省科学技术厅、江苏省财政厅、国家税务总局江苏省税务局 | 2018.11.28-2021.11.27 |
唯德康医疗已于2021年6月向有关主管部门提交高新技术企业资格再次认定申请,久虹医疗已于2021年8月向有关主管部门提交高新技术企业资格再次认定申请。
根据《高新技术企业认定管理办法》《高新技术企业认定管理工作指引》等相关规定,唯德康医疗和久虹医疗符合高新技术企业认定条件,重新通过高新技术企业认定不存在实质性障碍,具体如下:
| 认定条件 | 基本情况 | 是否符合 |
| (一)企业申请认定时须注册成立一年以上 | 唯德康医疗成立于2012年,成立已满一年以上 | 符合 |
| 久虹医疗成立于2003年,成立已满一年以上 | ||
| (二)企业通过自主研发、受让、受赠、并购等方式,获得对其主要产品(服务)在技术上发挥核心支持作用的知识产权的所有权 | 截至本报告书签署日,唯德康医疗通过自主研发取得获得对其主要产品在技术上发挥核心支持作用的知识产权的发明专利2项 | 符合 |
| 截至本报告书签署日,久虹医疗通过自主研发取得获得对其主要产品在技术上发挥核心支持作用的知识产权的发明专利1项 |
| 唯德康医疗主要产品发挥核心支持作用的技术属于《国家重点支持的高新技术领域》规定的范围:二、生物与医药技术之(五)医疗仪器、设备与医学专用软件之2、新型治疗、急救与康复技术 | 符合 | |
| 久虹医疗主要产品发挥核心支持作用的技术属于《国家重点支持的高新技术领域》规定的范围:二、生物与医药技术之(五)医疗仪器、设备与医学专用软件之2、新型治疗、急救与康复技术 | ||
| (四)企业从事研发和相关技术创新活动的科技人员占企业当年职工总数的比例不低于10% | 截至本报告书签署日,唯德康医疗研发人员占当期员工的比例不低于10% | 符合 |
| 截至本报告书签署日,久虹医疗研发人员占当期员工的比例不低于10% |
2-2-144
| 认定条件 | 基本情况 | 是否符合 |
| (五)企业近三个会计年度(实际经营期不满三年的按实际经营时间计算,下同)的研究开发费用总额占同期销售收入总额的比例符合如下要求:1.最近一年销售收入小于5,000万元(含)的企业,比例不低于5%;2.最近一年销售收入在5,000万元至2亿元(含)的企业,比例不低于4%;3.最近一年销售收入在2亿元以上的企业,比例不低于3%。其中,企业在中国境内发生的研究开发费用总额占全部研究开发费用总额的比例不低于60%; | 唯德康医疗母公司2020年度销售收入14,185.01万元,最近三个年度唯德康医疗研究开发费用总额占同期销售收入总额的比例均不低于4%。其中,企业在中国境内发生的研究开发费用总额占全部研究开发费用总额的比例不低于60%。 | 符合 |
| 久虹医疗2020年度销售收入22,108.62万元,最近三个年度久虹医疗研究开发费用总额占同期销售收入总额的比例均不低于3%。其中,企业在中国境内发生的研究开发费用总额占全部研究开发费用总额的比例不低于60%。 | ||
| (六)近一年高新技术产品(服务)收入占企业同期总收入的比例不低于60%认定条件 | 唯德康医疗近一年高新技术产品(服务)收入不低于60%认定条件 | 符合 |
| 久虹医疗近一年高新技术产品(服务)收入不低于60%认定条件 | ||
| (七)企业创新能力评价应达到相应要求 | 唯德康医疗和久虹医疗具有自主创新能力,在知识产权、科技成果转化能力、研究开发组织管理水平、企业成长性等方面能够达到企业创新能力评价应达到的要求 | 符合 |
| (八)企业申请认定前一年内未发生重大安全、重大质量事故或严重环境违法行为 | 根据唯德康医疗和久虹医疗当地政府主管部门出具的证明以及在当地政府官方网站检索,报告期内唯德康医疗和久虹医疗未发生重大安全、重大质量事故或严重环境违法行为 | 符合 |
综上,唯德康医疗和久虹医疗重新通过高新技术企业认定不存在实质性障碍。评估师对高新技术企业证书到期续期的可行性对本次盈利预测及评估结论的影响进行了假设分析。截至本次评估基准日,评估范围内享有高新技术企业资质认定的公司主体包括:唯德康医疗和子公司久虹医疗,在高新技术企业证书有效期内,公司可减按15%的企业所得税率缴纳企业所得税,根据前述分析本次评估假企业可长期维持高新技术企业评定,但如公司在高新技术企业证书到期后无法获得续展,则自2021年起恢复至25%的企业所得税率缴纳企业所得税。
2-2-145
假设唯德康医疗和久虹医疗无法获得高新技术企业证书续期,同时其他预测参数保持不变的情况下,对比本次盈利预测及评估结论的分析如下:
(1)对预测期合并口径归属于母公司净利润的假设分析
| 项目 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 |
| 盈利预测合并口径归母净利润(万元) | 9,997.77 | 11,980.93 | 14,395.26 | 16,481.01 | 18,543.82 |
| 按25%税率计算后的合并口径归母净利润(万元) | 9,307.66 | 11,138.78 | 13,407.68 | 15,348.30 | 17,278.41 |
| 差异率 | 7.41% | 7.56% | 7.37% | 7.38% | 7.32% |
在假设唯德康医疗和久虹医疗无法获得高新技术企业证书续期的情况下,公司合并口径归母净利润相比本次预测净利润在详细预测期内的差异率约为
7.32%至7.56%,高新技术企业证书复审程序对本次盈利预测标的公司归属于母公司净利润的影响较小。
(2)对本次评估所采用折现率的假设分析
| 项目 | 2021年全年 | 2022年 | 2023年 | 2024年 | 2025年 |
| 盈利预测采用折现率 | 12.00% | 12.00% | 12.00% | 12.00% | 12.00% |
| 按25%税率计算后的折现率 | 12.00% | 12.00% | 12.00% | 12.00% | 12.00% |
| 差异率 | 0.00% | 0.00% | 0.00% | 0.00% | 0.00% |
本次评估采用企业自由现金流进行预测,折现率采用加权平均资本成本(WACC)进行计算,其中:资本结构按公司实际资本结构计算,评估基准日时点,标的公司无付息债务。因此所得税率变化对折现率的计算不会产生影响。
(3)对收益法评估结论的假设分析
| 项目 | 收益法评估结论(万元) |
| 收益法评估结论 | 139,100.00 |
| 按25%税率计算后的评估结论 | 128,700.00 |
| 差异率 | 8.08% |
在假设唯德康医疗和久虹医疗无法获得高新技术企业证书续期的情况下,唯德康医疗100%股权价值经收益法测算估值为128,700.00万元,与本次收益法评估结论的差异率为8.08%。
2-2-146
(十二)境外经营和境外资产情况
报告期内,标的公司曾开立德国子公司Vedkang GmbH,但受新冠疫情影响进展受阻,已处于注销阶段,并未开展过实际业务。
八、标的公司财务报表的编制基础、合并财务报表范围及变化情况
(一)财务报表的编制基础
标的公司财务报表按照财政部颁布的《企业会计准则——基本准则》和各项具体会计准则、企业会计准则应用指南、企业会计准则解释及其他相关规定(以下合称“企业会计准则”),以及中国证券监督管理委员会《公开发行证券的公司信息披露编报规则第15号——财务报告的一般规定》的相关规定编制。
(二)合并财务报表范围及变化情况
1、合并财务报表范围
截至2021年6月30日,标的公司合并财务报表范围内子公司如下:
| 子公司名称 | 业务性质 | 是否纳入合并财务报表范围 | 取得 方式 | ||
| 2021年 6月30日 | 2020年 12月31日 | 2019年 12月31日 | |||
| 常州市久虹医疗器械有限公司 | 医疗器械生产和销售 | 是 | 是 | 是 | 同一控制下企业合并 |
| 常州锦福瑞医疗器械有限公司 | 医疗器械销售 | 是 | 是 | 是 | 设立 |
| 江苏图云医疗科技有限公司 | 医疗器械研发与生产 | 是 | 否 | 否 | 设立 |
| Vedkang Gmbh | 医疗器械销售 | 是 | 是 | 是 | 设立 |
| 常州市依漫生物科技有限公司 | 医疗产品灭菌 | 否 | 是 | 是 | 设立 |
| 常州市恒可模塑科技有限公司 | 模具生产与制造 | 是 | 否 | 否 | 设立 |
2、报告期内合并报表范围变更情况的说明
2021年3月,唯德康医疗通过同一控制下企业合并,完成收购久虹医疗100%股权,根据《企业会计准则第2号——长期股权投资》《企业会计准则第20号——企业合并》《企业会计准则第33号——合并财务报表》的相关规定,对于
2-2-147
同一控制下的控股合并,应视同合并后形成的报告主体自最终控制方开始实施控制时一直是一体化存续下来的,体现在其合并财务报表上,即由合并后形成的母子公司构成的报告主体,无论是其资产规模还是其经营成果都应持续计算;编制合并财务报表时,无论该项合并发生在报告期的任一时点,合并利润表、合并现金流量表均反映的是由母子公司构成的报告主体自合并当期期初至合并日实现的损益及现金流量情况,相应地,合并资产负债表的留存收益项目,应当反映母子公司如果一直作为一个整体运行至合并日应实现的盈余公积和未分配利润的情况;对于同一控制下的控股合并,在合并当期编制合并财务报表时,应当对合并资产负债表的期初数进行调整,同时应当对比较报表的相关项目进行调整,视同合并后的报告主体在以前期间一直存在。除上述变化外,2021年3月,久虹医疗将其持有的依漫生物56.40%的股权转让至倍瑞诗,将其持有的依漫生物37.60%的股权转让至伊斯源。本次股权转让后,标的公司及其子公司不再持有依漫生物股权,丧失了对其的控制权。2021年6月30日的合并报表中,标的公司不再将依漫生物纳入合并范围。2021年6月,标的公司新设全资子公司常州市恒可模塑科技有限公司。
九、报告期经审计的主要财务数据和财务指标情况
立信会计师对唯德康医疗根据同一控制下企业合并的相关要求,按照唯德康医疗收购久虹医疗后的架构追溯调整编制的2019年12月31日、2020年12月31日及2021年6月30日的合并资产负债表,2019年度、2020年度及2021年1-6月的合并利润表、合并现金流量表、合并所有者权益变动表以及相关财务报表附注进行了审计,出具了编号为信会师报字[2021]第ZA15640号的《审计报告》。根据《审计报告》,标的公司的最近两年一期合并财务报表主要财务数据和财务指标如下:
(一)简要资产负债表
单位:万元
| 项目 | 2021年6月30日 | 2020年12月31日 | 2019年12月31日 |
| 资产总额 | 32,547.10 | 30,351.21 | 24,407.45 |
| 负债总额 | 9,259.27 | 21,837.01 | 8,693.10 |
2-2-148
| 项目 | 2021年6月30日 | 2020年12月31日 | 2019年12月31日 |
| 股东权益合计 | 23,287.83 | 8,514.20 | 15,714.35 |
(二)简要利润表
单位:万元
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 |
| 营业收入 | 21,826.15 | 37,412.50 | 27,008.99 |
| 营业利润 | 2,297.59 | 10,328.46 | 7,027.05 |
| 利润总额 | 2,388.45 | 10,337.77 | 7,036.55 |
| 净利润 | 1,555.84 | 8,883.72 | 6,165.03 |
(三)简要现金流量表
单位:万元
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 |
| 经营活动产生的现金流量净额 | 5,461.88 | 8,158.65 | 7,178.16 |
| 投资活动产生的现金流量净额 | -2,315.32 | -2,496.92 | -566.89 |
| 筹资活动产生的现金流量净额 | -382.61 | -3,096.39 | -3,227.00 |
| 现金及现金等价物净增加额 | 2,730.83 | 2,230.74 | 3,444.33 |
(四)主要财务指标情况
| 项目 | 2021年6月30日/2021年1-6月 | 2020年12月31日/2020年度 | 2019年12月31日/2019年度 |
| 流动比率(倍) | 3.06 | 1.03 | 2.09 |
| 速动比率(倍) | 2.52 | 0.84 | 1.56 |
| 资产负债率 | 28.45% | 71.95% | 35.62% |
| 应收账款周转率(次) | 4.54 | 11.54 | 11.99 |
| 存货周转率(次) | 2.05 | 3.48 | 2.65 |
| 息税折旧摊销前利润(万元) | 2,644.46 | 10,742.81 | 7,357.44 |
| 归属于母公司股东的净利润(万元) | 1,594.75 | 8,887.99 | 6,165.95 |
注1:流动比率=流动资产/流动负债注2:速动比率=速动资产/流动负债=(流动资产-存货净额)/流动负债注3:资产负债率=负债总额/资产总额注4:应收账款周转率=营业收入/平均应收账款账面净额注5:存货周转率=营业成本/平均存货账面净额
2-2-149
十、标的公司报告期内主要会计政策及相关会计处理
(一)2020年以来收入的确认原则和计量方法
标的公司在履行了合同中的履约义务,即在客户取得相关商品或服务控制权时确认收入。取得相关商品或服务控制权,是指能够主导该商品或服务的使用并从中获得几乎全部的经济利益。与标的公司取得收入的主要活动相关的具体确认原则和计量方法描述如下:
(1)境内销售:标的公司根据销售协议(或销售订单)发出商品,标的公司交付商品、客户收货后确认销售收入,标的公司以客户签收为收入确认的时点,以签收记录、与客户的收货对账记录等为收入确认依据;
(2)境外销售:标的公司境外销售根据与客户签订协议的贸易方式不同,按照不同的方式确认收入:
采取工厂交货(EX-WORK)贸易方式的,根据合同约定公司在工厂或其他指定地点将货物交给购货方或其指定的承运人并由对方签收后,售出商品控制权即由标的公司转移至购货方,标的公司据此确认销售收入,标的公司以货物移交购货方或其指定的承运人为收入确认的时点,以交接单为收入确认依据;
采取船上交货(FOB)贸易方式的,标的公司在合同约定的装运港将货物交至指定船只并办妥出口报关手续,售出商品控制权即由标的公司转移至购货方,标的公司据此确认销售收入,标的公司以取得提单为收入确认的时点,以提单为收入确认依据。
(二)2019年及以前收入的确认原则和计量方法
1、销售商品收入确认和计量的总体原则
标的公司已将商品所有权上的主要风险和报酬转移给购买方;标的公司既没有保留与所有权相联系的继续管理权,也没有对已售出的商品实施有效控制;收入的金额能够可靠地计量;相关的经济利益很可能流入企业;相关的已发生或将发生的成本能够可靠地计量时,确认商品销售收入实现。
2-2-150
2、标的公司销售商品收入确认的标准及收入确认时间的具体判断标准标的公司销售商品收入确认的标准及收入确认时间的具体判断标准为标的公司交付商品并经客户确认且相关的经济利益很可能流入本企业。
3、关于标的公司销售商品收入相应的业务特点分析和介绍
(1)境内销售:标的公司根据销售协议(或销售订单)发出商品,标的公司交付商品、客户收货后确认销售收入,标的公司以客户签收为收入确认的时点,以签收记录、与客户的收货对账记录等为收入确认依据;
(2)境外销售:标的公司境外销售根据与客户签订协议的贸易方式不同,按照不同的方式确认收入;
采取工厂交货(EX-WORK)贸易方式的,根据合同约定标的公司在工厂或其他指定地点将货物交给购货方或其指定的承运人并由对方签收后,售出商品所有权上的主要风险和报酬即由标的公司转移至购货方,标的公司据此确认销售收入,标的公司以货物移交购货方或其指定的承运人为收入确认的时点,以交接单为收入确认依据;
采取船上交货(FOB)贸易方式的,标的公司在合同约定的装运港将货物交至指定船只并办妥出口报关手续,售出商品所有权上的主要风险和报酬即由标的标的公司转移至购货方,标的公司据此确认销售收入,标的公司以取得提单为收入确认的时点,以提单为收入确认依据。
(三)会计政策和会计估计与同行业或同类资产之间的差异及对拟购买资产利润的影响
经查阅同行业上市公司年报等资料,标的公司的收入确认原则和计量方法等主要会计政策和会计估计与同行业上市公司不存在重大差异,对标的公司利润无重大影响。
十一、拟购买资产为股权的说明
(一)交易标的出资及合法存续情况说明
截至本报告书签署日,唯德康医疗注册资本已足额缴纳,不存在出资瑕疵
2-2-151
或影响合法存续的情况,不存在破产、解散、清算以及其他根据中国法律和标的公司的公司章程相关规定需要终止的情形。
(二)交易标的股权是否为控股权的说明
本次交易中,奥赛康拟通过发行股份及支付现金的方式购买唯德康医疗60%股权,交易标的股权为控股权。
(三)本次交易是否已取得其他股东的同意或者符合标的公司的公司章程规定的股权转让前置条件
本次交易已经由标的公司股东会审议通过并取得其他股东的同意,符合标的公司的公司章程规定的股权转让前置条件。相关协议不存在影响标的公司独立性的条款或者其他安排。因此,本次标的资产符合转让条件。
十二、标的公司涉及立项、环保、行业准入、用地、规划、施工建设等有关报批事项
本次交易的标的资产为依法设立和存续的有限公司股权,不涉及立项、环保、行业准入、用地、规划、建设许可等有关报批事项。
十三、许可他人使用自己所有的资产或者作为被许可使用他人资产的情况
截至本报告书签署日,标的公司不存在许可他人使用自己资产的情况或作为被许可使用他人资产的情况。
十四、拟购买资产涉及的债权、债务转移
本次交易完成后,唯德康医疗仍然是独立存续的法人主体,其全部债权债务仍由其自身享有或承担。因此,本次交易不涉及债权债务的转移。
2-2-152
第五节 交易标的评估情况
一、交易标的评估情况
上市公司拟以发行股份及支付现金方式购买庄小金、缪东林、倍瑞诗、伊斯源合计持有的唯德康医疗60%股权。本次交易的评估机构上海东洲资产评估有限公司对唯德康医疗截至2021年3月31日的权益价值进行了评估。
根据东洲评估出具的东洲评报字【2021】第0759号《评估报告》,以2021年3月31日为基准日,标的公司和标的资产的评估情况如下:
单位:万元
| 评估方法 | 股东权益 账面价值 | 股东权益 评估价值 | 评估增减值 | 增减值 | 收购 比例 | 标的资产 评估价值 |
| A | B | C=B-A | D=C/A ×100% | |||
| 资产基础法 | 19,383.90 | 33,995.03 | 14,611.14 | 75.38% | 60.00% | 83,460.00 |
| 收益法 | 139,100.00 | 119,716.10 | 617.61% |
本次评估采用资产基础法和收益法进行评估,并以收益法评估结果作为标的资产的最终评估结论。在最终采用的收益法评估下唯德康医疗股东全部权益价值的评估值为139,100.00万元,较唯德康医疗经审计后母公司账面股东权益19,383.90万元增值119,716.10万元,增值率617.61%。对应标的资产评估值为83,460.00万元。
(一)评估对象与评估范围
评估范围为被评估单位全部资产及全部负债,具体包括流动资产、非流动资产及负债等。被评估单位申报的全部资产合计账面价值24,084.37万元,负债合计账面价值4,700.48万元,股东权益19,383.90万元。合并口径归属于母公司所有者权益19,585.38万元。委托评估范围与拟实施的经济行为所涉及的评估范围一致。
评估范围内的资产、负债账面价值业经过立信会计师事务所(特殊普通合伙)审计,出具了专项审计报告,报告文号信会师报字[2021]第ZA15069号。审计机构发表了标准无保留审计意见。
2-2-153
(二)评估基准日
本次资产评估基准日为2021年3月31日。
(三)评估方法
1、评估方法概述
依据《资产评估基本准则》,确定资产价值的评估方法包括市场法、收益法和成本法三种基本方法及其衍生方法。
依据《资产评估执业准则——企业价值》,执行企业价值评估业务可以采用收益法、市场法、资产基础法三种基本方法:
收益法是指将预期收益资本化或者折现,确定评估对象价值的评估方法。对企业价值评估采用收益法,强调的是企业的整体预期盈利能力。
市场法是指将评估对象与可比上市公司或者可比交易案例进行比较,确定评估对象价值的评估方法。
资产基础法是指以被评估单位评估基准日的资产负债表为基础,合理评估企业表内及可识别的表外各项资产、负债价值,确定评估对象价值的评估方法。对企业价值评估采用资产基础法,可能存在并非每项资产和负债都可以被充分识别并单独评估价值的情形。
2、评估方法的选择
依据《资产评估执业准则——企业价值》,“执行企业价值评估业务,应当根据评估目的、评估对象、价值类型、资料收集等情况,分析收益法、市场法、资产基础法三种基本方法的适用性,选择评估方法。”,“对于适合采用不同评估方法进行企业价值评估的,资产评估专业人员应当采用两种以上评估方法进行评估。”
资产基础法的基本思路是按现行条件重建或重置被评估资产,潜在的投资者在决定投资某项资产时,所愿意支付的价格不会超过购建该项资产的现行购建成本。本评估项目能满足资产基础法评估所需的条件,即被评估资产处于继续使用状态或被假定处于继续使用状态,具备可利用的历史经营资料。采用资
2-2-154
产基础法可以满足本次评估的价值类型的要求。
收益法是从资产的预期获利能力的角度评价资产,能完整体现企业的整体价值,其评估结果具有较好的可靠性和说服力。同时,被评估单位具备了应用收益法评估的前提条件:未来可持续经营、未来收益期限可以预计、股东权益与企业经营收益之间存在稳定的关系、未来经营收益可以预测量化、与企业预期收益相关的风险报酬能被估算计量。因此本次具备采用收益法评估的基本条件。市场法常用的两种具体方法是上市公司比较法和交易案例比较法,适用市场法的前提条件是存在一个发育成熟、公平活跃的公开市场,且市场数据比较充分,在公开市场上有可比的交易案例。经查询与被评估单位同一行业的国内上市公司,在产品类型、经营模式、企业规模、资产配置、未来成长性等方面具备可予比较的上市公司很少;且近期产权交易市场类似行业特征、经营模式的股权交易较少,相关交易背景、交易案例的经营财务数据等信息无法从公开渠道获得,不具备采用市场法评估的基本条件。综上分析,本次评估确定采用资产基础法和收益法进行评估。
(四)评估假设
本次评估遵循了以下评估假设和限制条件:
1、基本假设
(1)交易假设
交易假设是假定所有评估资产已经处在交易的过程中,根据评估资产的交易条件等模拟市场进行价值评估。交易假设是资产评估得以进行的一个最基本的前提假设。
(2)公开市场假设
公开市场假设是对资产拟进入的市场条件以及资产在这样的市场条件下接受何种影响的一种假定。公开市场是指充分发达与完善的市场条件,是指一个有自愿的买方和卖方的竞争性市场,在这个市场上,买方和卖方的地位平等,
2-2-155
都有获取足够市场信息的机会和时间,买卖双方的交易都是在自愿的、理智的、非强制性或不受限制的条件下进行。公开市场假设以资产在市场上可以公开买卖为基础。
(3)企业持续经营假设
企业持续经营假设是假设被评估单位在现有的资产资源条件下,在可预见的未来经营期限内,其生产经营业务可以合法地按其现状持续经营下去,其经营状况不会发生重大不利变化。
(4)资产按现有用途使用假设
资产按现有用途使用假设是指假设资产将按当前的使用用途持续使用。首先假定被评估范围内资产正处于使用状态,其次假定按目前的用途和使用方式还将继续使用下去,没有考虑资产用途转换或者最佳利用条件。
2、一般假设
(1)本次评估假设评估基准日后国家现行有关法律、宏观经济、金融以及产业政策等外部经济环境不会发生不可预见的重大不利变化,亦无其他人力不可抗拒及不可预见因素造成的重大影响。
(2)本次评估没有考虑被评估单位及其资产将来可能承担的抵押、担保事宜,以及特殊的交易方式可能追加付出的价格等对其评估结论的影响。
(3)假设被评估单位所在地所处的社会经济环境以及所执行的税赋、税率等财税政策无重大变化,信贷政策、利率、汇率等金融政策基本稳定。
(4)被评估单位现在及将来的经营业务合法合规,并且符合其营业执照、公司章程的相关约定。
3、收益法评估特别假设
(1)被评估单位的未来收益可以合理预期并用货币计量;预期收益所对应的风险能够度量;未来收益期限能够确定或者合理预期。
(2)被评估单位目前及未来的管理层合法合规、勤勉尽职地履行其经营管理职能,本次经济行为实施后,亦不会出现严重影响企业发展或损害股东利益
2-2-156
情形,并继续保持现有的经营管理模式和管理水平。
(3)未来预测期内被评估单位核心管理人员和技术人员队伍相对稳定,不会出现影响企业经营发展和收益实现的重大变动事项。
(4)被评估单位于评估基准日后采用的会计政策和编写评估报告时所采用的会计政策在重要性方面保持一致。
(5)假设评估基准日后被评估单位的现金流均匀流入,现金流出为均匀流出。
(6)被评估单位及其子公司久虹医疗的《高新技术企业证书》取得日期为2018年,有效期3年。假设现行高新技术企业认定的相关法规政策未来无重大变化,在对企业目前的主营业务构成类型、研发人员构成、未来研发投入占主营收入比例等指标分析后,基于对未来的合理推断,假设被评估单位未来具备持续获得高新技术企业认定的条件,能够持续享受所得税优惠政策。
(7)被评估单位及其控股长期股权投资单位部分生产经营场所系租赁取得,本次评估假设该租赁合同到期后,被评估单位能按租赁合同的约定条件获得续签继续使用,或届时能以市场租金价格水平获取类似条件和规模的经营场所。
(8)本次评估假设被评估单位目前拥有的医疗器械产品备案/注册证、医疗器械生产许可证等经营资质均可在到期后得到续展,企业经营不因资质到期而产生影响。
(五)唯德康医疗资产基础法介绍
资产基础法具体是指将构成企业的各种要素资产的评估值加总减去负债评估值求得企业股东全部权益价值的方法。
各类主要资产及负债的评估方法如下:
1、货币资金
货币资金包括现金、银行存款。对人民币现金及银行存款,以核实后的金额为评估值;对外币现金及银行存款,按核实后外币账面金额乘以基准日人民
2-2-157
币与外币汇率后确定评估值。
2、应收款项
对于应收款项,主要包括应收账款和其他应收款。各种应收款项在核实无误的基础上,根据每笔款项可能收回的数额确定评估值。对于有充分理由相信全都能收回的,按全部应收款额计算评估值;对于很可能收不回部分款项的,在难以确定收不回账款的数额时,借助于历史资料和现场调查了解的情况,具体分析数额、欠款时间和原因、款项回收情况、欠款人资金、信用、经营管理现状等,按照账龄分析法,估计出这部分可能收不回的款项,作为风险损失扣除后计算评估值;账面上的“坏账准备”科目按零值计算。
3、预付账款
根据所能收回的相应资产或权利的价值确定评估值。对于能够收回的相应资产或权利的,按核实后的账面值作为评估值。
4、存货类
存货包含原材料、委托外加工物资、产成品、在产品等。具体评估方法如下:
(1)原材料
对原材料,主要采用市价途径进行评估,评估值等于不含税市场购入价和其他合理费用确定,其中对于公司已计提跌价准备、临近保质期的原材料,考虑到其基本没有处置收益,本次将其评估为零。
(2)委托外加工物资
委托外加工物资主要为委托外部加工的原材料,本次参照原材料的评估方法对其进行评估。
(3)产成品(库存商品)
根据企业产品实际能实现销售的不含增值税价格扣除与实现销售相关的费用、税金(含所得税),并根据实际销售状况扣除适当的利润后确定评估单价,并在核实数量后确定评估值。计算公式为:
2-2-158
产成品评估值=数量×不含税销售单价-销售相关费用及税金-适当利润产成品评估值=产成品评估单价×数量其中:
不含税销售单价:根据相应的合同或近期销售订单确定;销售相关费用及相关税金,根据经审计后的相关财务数据计算得到相关费用率、税金率。
所得税率:根据被评估单位基准日当年实际适用的所得税率确定。扣减的适当利润:根据产成品的预计销售状况,以估计的净利润折减率进行计算。
对于公司已计提跌价准备、临近保质期的产成品,考虑到其基本没有处置收益,本次将其评估为零;对于公司代理销售的支架产品,考虑到其为基准日前新购置产品,购入成本与市场价值基本一致,因此本次按账面值评估。
(4)在产品
在产品为被评估单位于基准日尚未完工的产品,本次结合各在产品的完工进度、预计完工成本和预计不含税销售价格的基础上,参照对应产成品的评估方法确定评估值。
(5)发出商品
参照产成品的方式进行评估。
5、其他流动资产
其他流动资产根据其尚存受益的权利或可收回的资产价值确定评估值。
6、长期股权投资
截至本次评估基准日,被评估单位账面长期股权投资情况如下:
| 序号 | 被投资单位名称 | 持股比例% | 账面价值(元) |
| 1 | 常州久虹医疗器械有限公司 | 100.00 | 18,410,647.80 |
2-2-159
| 序号 | 被投资单位名称 | 持股比例% | 账面价值(元) |
| 2 | 常州锦福瑞医疗器械有限公司 | 100.00 | 2,000,000.00 |
| 3 | 江苏图云医疗科技有限公司 | 80.00 | 8,000,000.00 |
| 4 | Vedkang GmbH | 100.00 | 189,645.55 |
| 合计 | 28,600,293.35 |
(1)对全资和控股的长期股权投资本次进行整体资产评估,并根据母公司对被投资单位的持股比例分别计算各长期股权投资评估值。
(2)对基准日无经营业务且正在注销中的子公司,考虑到其资产仅保有货币资金,同时经调查了解无其他增减值情况,故本次对其基准日报表资产负债进行核查评估后,结合持股比例确定评估值。
7、其他权益工具投资
截至本次评估基准日,被评估单位账面其他权益工具投资情况如下:
| 序号 | 被投资单位名称 | 投资日期 | 持股比例 | 账面价值(元) |
| 1 | 常州医疗器械产业研究院有限公司 | 2014/05/15 | 5.00% | 448,936.29 |
| 合计 | - | - | 448,936.29 |
对于其他权益工具投资,因受制于控制权因素未能对该公司进行整体评估,本次按被投资企业基准日资产负债表中净资产账面值结合持股比例确定其评估值。
8、不动产
根据《资产评估执业准则——不动产》,不动产是指土地、建筑物及其他附着于土地上的定着物。不动产通常在投资性房地产、固定资产以及无形资产等科目中核算。
执行不动产评估时应根据具体情况分析市场法、收益法和成本法三种基本评估方法以及假设开发法、基准地价修正法等衍生方法的适用性,选择评估方法。
从2016年5月1日起,在全国范围内全面实现营业税改征增值税,建筑业、房地产业、金融业、生活服务业等由缴纳营业税改为缴纳增值税。由于增值税是价外税,因此本次评估对象所涉及的不动产评估值均不含增值税。
2-2-160
本次对唯德康医疗和久虹医疗所拥有的不动产均采用房地合一的市场法和收益法进行评估。
(1)市场法介绍
市场法指在一定市场条件下,选择条件类似或使用价值相同若干房地产交易实例,就交易情况、交易日期、房地产状况等条件与委估对象进行对照比较,并对交易实例房地产加以修正调整,从而确定委估对象价值的方法。
基本公式:
委估对象价格=可比实例交易价格×交易情况修正系数×市场状况修正系数×房地产状况修正系数。
(2)收益法介绍
收益法主要为调查同一区域、相同类型的物业的正常租金及出租率,结合委评对象的现状,调整确定一个客观的租金水平及出租率,扣除日常的管理、维修、保险、税收及支付给房产部门的租金等费用,得出委评对象每年的客观纯收益,选取合理的折现率,运用适当的公式计算得到委评对象的收益价值。
计算公式:P =
其中:P-评估值(折现值);r-所选取的折现率;n-收益年期;
Fi-未来收益期的预期年收益额
租赁收入是由被评估单位实际租约约定租金或者租约期外客观租金×(1-空置率及租金损失率)后获得。
年运营费用包括管理费、维修费、保险费、房产税、增值税及附加等。
9、设备类资产
根据《资产评估执业准则——机器设备》,执行机器设备评估业务,应当根据评估目的、评估对象、价值类型、资料收集等情况,分析成本法、市场法和收益法三种资产评估基本方法的适用性,选择评估方法。本次通过对所涉及的各类设备特点、用途以及资料收集情况分析,主要采用成本法进行评估。
2-2-161
通过对被评估单位所涉及的各类设备特点、用途以及资料收集情况分析,主要采用重置成本法进行评估。成本法:根据现行时点条件下按照重建或者重置被评估对象设备的思路,即基于社会一般生产力水平的客观必要成本为基础,扣除相关贬值(实体性贬值、功能性贬值和经济性贬值),以此确定评估对象价值的资产评估方法。重置成本一般为更新重置成本,包括直接成本、间接成本、资金成本、税费及合理的利润。
评估价值=重置成本-实体性贬值-功能性贬值
=重置成本×综合成新率
(1)机器设备及其他电子设备
1)重置成本的确定
机器设备重置成本由设备购置价、运杂费、安装调试费、前期工程及其他费用、资金成本等组成(或是购建所发生的必要的、合理的成本、利润和相关税费等确定)。对价值量较小的电子及其他设备,无需安装(或安装由销售商负责)以及运输费用较低,直接参照现行不含税市场购置价格确定。
根据2009年1月1日起实施的《中华人民共和国增值税暂行条例》(中华人民共和国国务院令第538号),《中华人民共和国增值税暂行条例实施细则》(财政部国家税务总局令第50号),《财政部,国家税务总局关于全国实施增值税转型改革若干问题的通知》(财税[2008]170号)及财政部、国家税务总局财税(2009)113号《关于固定资产进项税额抵扣问题的通知》的相关规定,自2009年1月1日起,增值税一般纳税人购进或者自制固定资产发生的进项税额,可凭增值税专用发票,海关进口增值税专用缴款书和运输费用结算单据从销项税额中抵扣。故本次评估中对于符合上述条件设备的重置成本中均不含增值税。
重置全价计算公式:
设备重置全价(不含增值税)=设备购置价(不含增值税)+运杂费(不含增值税)+安装调试费(不含增值税)+前期工程及其他费用(不含增值税)+
2-2-162
资金成本
对价值量较小的电子及其他设备,无需安装(或安装由销售商负责)以及运输费用较低,参照现行不含税市场购置价格确定。
①设备购置价的确定
对大型关键设备,通过向设备的生产厂家、代理商及经销商咨询评估基准日有效的市场价格,或参考评估基准日近期同类设备的合同价格确定;对中小设备通过查询评估基准日的设备报价信息确定;对没有直接市场报价信息的设备,主要通过参考同类设备的现行市场购置价确定。
②运杂费、安装调试费、前期工程及其他费用的确定
运杂费、安装调试费参照《机械工业建设项目概算编制办法及各项概算指标》中有关规定、《资产评估常用数据与参数手册》以及相关安装定额合理确定。
对小型、无须安装的设备,不考虑安装调试费。
前期工程及其他费用根据国家各部委颁发的基准日有效的取价文件确定。
③资金成本的确定
考虑到公司拥有的设备类固定资产大部分为现货供应,且单项设备的价值量较小,故本次不考虑资金成本的计算。
2)综合成新率的确定
综合成新率=理论成新率×调整系数K
其中:理论成新率=尚可使用年限÷(已使用年限+尚可使用年限)×100%
调整系数K=K1×K2×K3×K4×K5
各类调整系数主要系对设备的原始制造质量、设备的运行状态及故障频率、维护保养(包括大修理等)情况、设备的利用率、设备的环境状况等进行勘查了解后确定。
一般简单设备综合成新率直接采用理论成新率或观测值确定。
2-2-163
3)评估值的确定评估值=重置全价×综合成新率
(2)运输车辆设备
1)重置成本的确定按评估基准日的运输车辆设备的市场价格,并根据《中华人民共和国车辆购置税法》及当地相关文件计入车辆购置税、新车上户牌照手续费等,确定其重置成本:
2)综合成新率的确定根据《机动车强制报废标准规定》(商务部、发改委、公安部、环境保护部令2012年第12号)的有关规定,结合《资产评估常用参数手册》中关于“车辆经济使用年限参考表”推算确定的运输车辆尚可经济使用年限和尚可经济行驶里程数,并以年限计算结果作为车辆基础成新率,同时以车辆的实际行使里程数量化为车辆利用率修正系数,再结合其它各类影响因素对基础成新率进行修正后合理确定综合成新率。3)评估值的确定评估值=重置成本×综合成新率对基准日期后已处置的设备,本次对其按处置价进行评估。10、使用权资产使用权资产为被评估单位租赁的厂房在租赁期内使用的权利,评估人员对企业的摊销过程进行了核查。使用权资产摊销正常,账面值基本属实。本次按照核实后的账面值进行评估。
11、无形资产-其他无形资产
无形资产主要账面已反映的外购软件及账面未反映的已授权专利、注册商标和域名等。根据《资产评估执业准则——无形资产》,确定无形资产价值的评估方法包括市场法、收益法和成本法三种基本方法及其衍生方法。对所涉及
2-2-164
的评估对象相关情况以及资料收集情况充分了解,并分析上述三种基本方法的适用性后选择合理的评估方法。收益法:在获取评估对象无形资产相关信息基础上,根据该无形资产或与其类似无形资产的历史实施情况及未来应用前景,结合该无形资产实施或者拟实施企业经营状况,估算其能带来的预期收益,采用与预期收益口径一致的折现率折现的方式得到评估对象无形资产市场价值。市场法:在获知评估对象无形资产或者类似无形资产存在活跃市场的基础上,收集具有比较基础的类似无形资产可比交易案例的市场交易价格、交易时间及交易条件等交易信息,并对交易信息进行必要的调整后得到评估对象无形资产市场价值。成本法:根据形成无形资产的全部投入,考虑无形资产价值与成本的相关程度,通过计算其合理的成本、利润和相关税费后确定其重置成本,并考虑其贬值因素后得到评估对象无形资产市场价值。
(1)已授权专利
1)对于唯德康医疗合并范围内正在使用中且能够为企业带来超额收益的已授权专利,本次将其作为资产组采用收益法——收入分成法进行评估。具体计算公式为:
式中:P-无形资产的评估值;
r-选定的折现率;
n-评估预测年限;
Fi-未来第i个收益期的预期的营业收入;
w-无形资产收入分成率。
2)对于评估基准日公司已不再使用且未来计划不再复用的已授权专利,经调查了解,该部分专利主要为公司研发人员在其他项目研发过程中形成的一些
2-2-165
附加与次要的研发成果,并非公司核心技术,且其历史成本较难独立进行归集与统计。本次谨慎考虑对该部分专利评估为零。
(2)注册商标
被评估单位拥有的产品商标主要是企业产品区别于其他企业产品的一个标识,其对企业收益的影响难以量化,与企业产品的收入、规模没有必然的联系,故本次采用成本法评估。
(3)域名
对被评估单位拥有的域名,考虑到其对企业收益的影响难以量化,与企业产品的收入、规模没有必然的联系,故本次采用成本法评估。
12、长期待摊费用
长期待摊费用系企业发生的房屋装修费,经核实入账价值准确,摊销正常。本次对租赁房屋发生的装修费按照其剩余权益确定评估值。
13、递延所得税资产
递延所得税资产是被评估单位核算资产在后续计量过程中因企业会计准则规定与税法规定不同而产生的可抵扣暂时性差异。本次评估在调查了解递延所得税资产的内容和形成过程,根据对应科目的评估处理情况,重新计算确认递延所得税资产评估值。
14、其他非流动资产
其他非流动资产系企业发生的预付设备款,本次按其尚存受益的权利或可收回的资产价值确定评估值。
15、负债
负债主要包括流动负债和非流动负债。在清查核实的基础上,以各项负债在评估目的经济行为实施后被评估单位实际需要承担的债务人和负债金额确定评估值。
2-2-166
(六)唯德康医疗收益法介绍
根据《资产评估执业准则—企业价值》,现金流量折现法(DCF)是收益法常用的方法,即通过估算企业未来预期现金流量和采用适宜的折现率,将预期现金流量折算成现时价值,得到股东全部权益价值。现金流量折现法通常包括企业自由现金流折现模型和股权自由现金流折现模型。
根据本次评估尽职调查情况以及评估对象资产构成和主营业务的特点,本次评估的基本思路是以评估对象经审计的会计报表口径为基础估算其权益资本价值。即首先按收益途径采用现金流折现方法(DCF),估算评估对象的经营性资产的价值,再加上基准日的其他非经营性或溢余性资产的价值,来得到评估对象的企业价值。企业价值再扣减付息债务价值后,得出评估对象的股东全部权益价值。
1、评估思路及模型
(1)具体估值思路
1)对纳入报表范围的资产和主营业务,按照最近几年的历史经营状况的变化趋势和业务类型估算预期收益(净现金流量),并折现得到经营性资产的价值。
2)将纳入报表范围,但在预期收益(净现金流量)估算中未予考虑的诸如基准日存在的溢余资产,以及定义为基准日存在的非经营性资产(负债),单独估算其价值。
3)由上述二项资产价值的加和,得出评估对象的企业价值,再扣减付息债务价值以后,得到评估对象的权益资本(股东全部权益)价值。
4)本次以江苏唯德康医疗科技有限公司合并口径财务报表为基础,对所有合并报表范围内的公司均进行单独预测后进行内部抵消,最终以合并报表形式进行收益法评估。
(2)评估模型
本次评估选择企业自由现金流模型。
2-2-167
本次评估的基本模型为:
式中:
E:评估对象的股东全部权益价值;D:评估对象的付息债务价值;B:评估对象的企业价值;
DBE???
??
i
CPB
P:评估对象的经营性资产价值;
?
??
i
CPB
??
??????
nnni
ii
rgrgFrFp
??????????
式中:r:所选取的折现率:
资产评估专业人员,在综合考虑评估基准日的利率水平、市场投资收益率等资本市场相关信息和所在行业、被评估单位的特定风险等相关因素确定折现率。Fi:评估对象未来第i年的预期收益(现金流);n:明确的预测期期间是指从评估基准日至企业达到相对稳定经营状况的时间。评估人员在对企业收入结构、成本结构、资本结构、资本性支出、投资收益和风险水平等综合分析的基础上,结合宏观政策、行业周期及其他影响企业进入稳定期的因素,确定预测期。本次明确的预测期期间n选择为5年。根据被评估单位所在行业现状与发展前景、协议与章程约定、经营状况、资产特点和资源条件等,确定预测期后收益期确定为无限期。
g-未来收益每年增长率,根据企业进入稳定期的因素分析预测期后的收益趋势,本次评估假定n年后Fi不变,G取零。
2-2-168
ΣCi:评估对象基准日存在的溢余资产、非经营性资产或负债的价值。
(3)收益指标
本次评估,使用企业的自由现金流量作为评估对象的收益指标,其基本定义为:
企业自由现金流=净利润+税后的付息债务利息+折旧和摊销-资本性支出-营运资金增加根据评估对象的经营历史以及未来盈利预测,估算其未来预期的自由现金流量。将未来经营期内的自由现金流量进行折现处理并加和,测算得到企业经营性资产价值。
(4)折现率
本次评估采用资本资产加权平均成本模型(WACC)确定折现率R:
式中:
??
eedd
WRWTRR??????1
d
W
:评估对象的付息债务比率;
d
W
)(DEDW
d
??
)(DE
DW
d
??
e
W
:评估对象的权益资本比率;
e
W
)(DE
EW
e
??
)(DE
EW
e
??
T
:所得税率;
Td
R
:付息债务利率;
d
R
e
R
:权益资本成本,按资本资产定价模型(CAPM)确定权益资本成本;
e
R??????MRPRRefe
式中:
2-2-169
:无风险报酬率;
fRMRP
:市场风险溢价;ε:评估对象的特定风险调整系数;
MRPe?
:评估对象权益资本的预期市场风险系数;
e?
))1(1(EDtt
e
???????
式中:
))1(1(EDtt
e
???????
t?
为可比公司的预期无杠杆市场风险系数;D、E:分别为被评估单位的付息债务与权益资本。被评企业按公历年度作为会计期间,因而本项评估中所有参数的选取均以年度会计数据为准,以保证所有参数的计算口径一致。
2、评估过程
(1)主营业务收入预测
本次对标的公司主营业务收入的预测采用量价分析的方式进行计算即:
大类产品销售收入=销售数量×平均销售单价由于标的公司产品型号类型较多,本次按平均销售单价进行预测,数量以各型号数量累加确定。本次以标的公司主营业务收入占比最高的基础诊断类产品进行举例分析如下:
1)基础诊断类单价的预测基础诊断类产品主要包括:一次性使用活体取样钳、内窥镜用异物钳、医用球囊压力泵、一次性使用息肉切除器、活检阀、清洁刷、食道贲门狭窄扩张器等细分类别产品。
A.2021年销售单价的预测基础诊断类产品2019年、2020年和2021年1-3月的加权平均单价呈现小
2-2-170
幅上升趋势,经分析主要原因一方面系各会计年度基础诊断类产品销售量的内部结构比重略有变化,另一方面标的公司少量新产品上市时的销售单价较高,基于以上两方面的原因标的公司基础诊断类产品的平均单价在报告期内略微上升。本次评估以2021年1-3月的加权平均单价为基础,预计2021年全年将维持该单价水平,并以此为基础对2022年及以后年度进行预测。
B.2022年及以后年度销售单价的预测随着国家医改政策不断出台以及带量集采的推行,医用耗材带量采购已是大势所趋。2020年末,首轮国家级医疗器械集中采购谈判正式结束,包括冠脉支架、人工晶体、人工关节、冠脉球囊等高值医用耗材谈判后的中标价格均有不同程度下降。从两次医疗器械全国集采的产品信息看,主要集中在产品成熟、竞争激烈、高附加值、用户基础大的产品上。虽然被评估单位产品截至目前均未进入带量采购清单范围,但随着医疗改革的深入,标的公司产品未来也将受到行业相关政策的影响。鉴于相关政策推行时间尚存在不确定性,以及出于对预测期标的公司整体财务指标结构与报告期的匹配性考虑,本次盈利预测按产品单价分年度逐步下降进行预测,即预测2022年至2025年基础诊断类产品平均单价每年下降5%,永续期前一年下降幅度为1%,经计算复合增长率为-4.02%,首末年下降幅度为15.11%。除此之外,本次谨慎考虑在标的公司产品单价预测下降的基础上,还适当增加公司了销售费用的预测金额与占比。
随着集采的常态化发展,市场优胜劣汰将刺激企业的科技创新和产品迭代。为应对挑战,标的公司管理层也制定了一系列应对措施,其中最主要的是增加新产品的研发投入和现有产品的更新迭代。截至本次评估基准日,被评估单位在研项目共计25项,其中涵盖ESD类、基础诊断类、ERCP类等收入大类。鉴于新产品在上市初期的销售单价相较于同类型的现有产品略高,丰富的在研产品管线在未来实现成果转化后将对标的公司的产品的平均销售单价起到有力的支撑作用,可以在一定程度上可以缓解产品大类销售单价下降的压力。2)销售数量的预测2020年,受新冠肺炎疫情影响,就诊患者人数降低,导致基础诊断类产品的销售量未能实现快速上升,当年销量增长率为18%。进入2021年,随着国际
2-2-171
国内疫情防控的良好进展,基础诊断类产品2021年1-3月已实现销售量117.50万件,2021年1-3月已实现2020年销售量的35%。按年化计算,2021年预计可实现销售量为470万件,相比2020年约增长40%,故本次对2021年销售量按40%的增长率进行预测,预测销售量为466.49万件。2022年及以后年度,考虑到市场竞争等因素,预测销量增长率逐年下降。
综上所述,本次对唯德康医疗单体基础诊断类产品的预测情况如下:
单位:万元
| 序号 | 项目\年份 | 2021 | 2022 | 2023 | 2024 | 2025 |
| 1 | 销售收入 | 7,675.01 | 10,207.76 | 13,091.45 | 15,546.10 | 17,699.23 |
| 2 | 增长率 | 44.22% | 33.00% | 28.25% | 18.75% | 13.85% |
| 3 | 销售数量 | 466.49 | 653.09 | 881.67 | 1,102.08 | 1,267.40 |
| 4 | 增长率 | 40.00% | 40.00% | 35.00% | 25.00% | 15.00% |
| 5 | 销售单价 | 16.45 | 15.63 | 14.85 | 14.11 | 13.97 |
| 6 | 增长率 | - | -5.00% | -5.00% | -5.00% | -1.00% |
其他产品大类参照基础诊断类产品的预测方式进行预测。唯德康医疗委托生产业务收入来源于与子公司久虹医疗之间的关联交易,本次按历史年度水平进行预测后进行合并抵消。唯德康医疗单体主营业务收入预测情况如下:
| 序号 | 项目\年份 | 单位 | 2021 | 2022 | 2023 | 2024 | 2025 |
| 主营收入分析 | |||||||
| 1 | 其中:基础诊断类 收入 | 万元 | 7,675.01 | 10,207.76 | 13,091.45 | 15,546.10 | 17,699.23 |
| 增长率 | 44.22% | 33.00% | 28.25% | 18.75% | 13.85% | ||
| 2 | ESD类收入 | 万元 | 3,150.74 | 3,891.16 | 4,620.76 | 5,487.15 | 6,247.12 |
| 增长率 | 3.02% | 23.50% | 18.75% | 18.75% | 13.85% | ||
| 3 | ERCP类收入 | 万元 | 1,593.27 | 2,119.05 | 2,657.28 | 2,903.08 | 3,161.46 |
| 增长率 | 0.12% | 33.00% | 25.40% | 9.25% | 8.90% | ||
| 4 | 泌尿骨科类收入 | 万元 | 301.58 | 343.80 | 375.60 | 392.50 | 427.43 |
| 增长率 | 233.03% | 14.00% | 9.25% | 4.50% | 8.90% | ||
| 5 | 医用配件类收入 | 万元 | 171.60 | 208.07 | 232.10 | 247.65 | 269.69 |
| 增长率 | 50.78% | 21.25% | 11.55% | 6.70% | 8.90% |
2-2-172
| 序号 | 项目\年份 | 单位 | 2021 | 2022 | 2023 | 2024 | 2025 |
| 6 | 止血闭合类收入 | 万元 | 4,326.20 | 5,014.07 | 5,477.87 | 5,984.57 | 6,813.44 |
| 增长率 | 38.83% | 15.90% | 9.25% | 9.25% | 13.85% | ||
| 7 | 委托生产业务收入 | 万元 | 845.72 | 1,088.84 | 1,326.08 | 1,435.52 | 1,568.09 |
| 增长率 | 4.04% | 28.75% | 21.79% | 8.25% | 9.23% | ||
| 主营业务收入小计 | 18,064.12 | 22,872.74 | 27,781.14 | 31,996.57 | 36,186.46 | ||
| 增长率 | 28.07% | 26.62% | 21.46% | 15.17% | 13.09% | ||
其余子公司主营业务收入参照母公司预测方法进行,合并口径整体主营业务收入预测表详见下表:
单位:万元
| 项目\年份 | 2020年 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 主营业务收入 | 37,390.48 | 41,951.23 | 51,774.87 | 63,194.88 | 72,447.15 | 81,503.98 |
| 增长率 | 12.20% | 23.42% | 22.06% | 14.64% | 12.50% |
预测期2021年被评估单位合并口径主营业务收入预测实现41,951.23万元,相较于2020年增长12.20%。2020年受到疫情因素的影响,唯德康医疗投入了一定的产能用于医用口罩的生产,当年合计实现销售收入6,090.60万元,剔除掉该部分影响后,2021年相比2020年的主营业务收入增长率为34.03%,以后年度年增长率略有放缓至预测期末年主营业务收入增长率为12.50%。
(2)主营业务成本预测
唯德康医疗(合并口径)近年主营业务成本情况如下:
单位:万元
| 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 主营业务成本 | 10,402.65 | 15,309.77 | 3,795.16 |
| 毛利率 | 61.45% | 59.05% | 58.85% |
本次预测期内,评估师将唯德康医疗单体成本划分为料、工、费三类进行分析测算。
1)唯德康医疗单体原材料的预测
被评估单位生产所需的基本物料包括芯管、弹簧管、外管、导管、球囊等,均主要通过目录内供应商采购。成本透明,且不存在较高的市场竞争性,由于
2-2-173
原材料与收入呈现明显的对应关系,因此本次按照其占历史年度收入的比例进行预测。2)唯德康医疗单体工资薪酬的预测本次对工资薪酬主要从以下两个方面进行分析预测:
A.人员增加数量鉴于公司目前的产品生产仍较为依赖劳动力的投入,随着企业生产规模的扩大,势必将新增车间生产人员以补充产能,因此对人员数量在2021年1-3月的水平上预测每年增加约20人,按比例计算每年增加比例约为前一年的15%。另子公司久虹医疗根据公司整体规划未来将作为重点的生产基地,因此预测期内每年增加的车间生产人员在40-60人之间,按比例计算每年增加比例约为前一年的25%。B.平均人员工资对平均工资,本次参照被评估单位当地的工资标准,在2020年的基础上按照一定比例逐年增长。3)唯德康医疗单体制造费用的预测制造费用主要包含折旧费、检测、维修费、低值易耗品消耗、加工费以及其他费用等构成。固定资产折旧:主要为被评估单位房屋建筑物及设备每年发生的折旧,本次按照固定资产的折旧政策,未来年度在营业成本及期间费用中分摊确认。检测、维修费:考虑到该类成本与公司主营业务收入的关联性并不明细,故本次按一定比例预测增长。
租金:考虑到被评估单位未来随着生产规模的扩张,未来对生产场地也有相应的需求,故本次自2023年开始考虑一定的场地租赁带来的成本增加,按4,000平方米租赁面积及1元/天·平方米的单价水平进行预测,未来年度保持每年3%的租金单价增长率。
对电费、低值易耗品摊销、加工费等其他费用:考虑到其与生产经营的关
2-2-174
联性较强,本次按历史年度该项成本占主营业务收入的比例进行预测。其余公司主营业务成本参照母公司的预测方式进行预测。合并整体主营业务成本预测表详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 主营业务成本 | 16,900.37 | 21,238.51 | 26,080.42 | 29,969.74 | 33,751.25 |
| 毛利率 | 59.71% | 58.98% | 58.73% | 58.63% | 58.59% |
(3)其他业务收入和成本预测
唯德康医疗(合并口径)近年其他业务收入和成本情况如下:
单位:万元
| 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 其他业务收入 | 22.08 | 22.02 | 6.89 |
| 其他业务成本 | 7.35 | 7.35 | - |
其他业务收入和成本的预测:
对于其他业务收入,标的公司历史年度中主要为零星废品出售收入,本次预测未来年度其他业务收入有一定的增长率;对于其他业务成本,主要为久虹投资性房地产计提的折旧,评估师本次已将其作为非经营性资产考虑,故对未来其他业务成本不做预测。合并整体其他业务收入及成本预测表详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 其他业务收入 | 23.00 | 19.32 | 19.90 | 20.50 | 21.12 |
| 其他业务成本 | - | - | - | - | - |
(4)税金及附加预测
唯德康医疗(合并口径)近年经评估非市场化因素调整后税金及附加情况如下:
单位:万元
| 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 税金及附加 | 339.45 | 401.45 | 128.72 |
2-2-175
| 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 占营业收入比例 | 1.26% | 1.07% | 1.39% |
评估对象的税项主要有增值税、城建税及教育税附加、房产税、土地使用税等。本次评估根据上述各项计税原则对未来各项应交税费和税金及附加进行预测。合并整体税金及附加预测见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 税金及附加 | 477.77 | 563.07 | 691.25 | 807.14 | 897.35 |
| 占营业收入比例 | 1.14% | 1.09% | 1.09% | 1.11% | 1.10% |
(5)销售费用预测
唯德康医疗(合并口径)近年经评估非市场化因素调整后销售费用情况如下:
单位:万元
| 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 销售费用 | 4,178.91 | 4,728.85 | 1,023.47 |
| 占营业收入比例 | 15.47% | 12.64% | 11.09% |
1)唯德康医疗销售费用预测
①折旧摊销:被评估单位基准日销售费用中涉及固定资产折旧摊销金额很小,故不予预测,整体折旧摊销已在其他成本费用中考虑;
②职工薪酬:主要从销售人员数量及平均人员工资两方面进行预测。考虑到公司主要以自有团队进行市场宣传与推广,随着未来销售收入的增加,势必需要扩大销售团队,优化销售模式。因此本次对销售人员数量及销售人员平均工资均预测了增加;
③租赁费、办公费、咨询费:未来年度预测一定的增长率;
④运输费、差旅费:与被评估单位的主营业务收入显强对应性,未来继续假设其占主营业务收入一定比例预测;
2-2-176
⑤会务费、业务宣传费:该类费用和被评估单位的营业收入显著相关,未来年度按照收入的比例预测,未来为维持收入规模的上涨,该比例将表现一定的上升趋势;
⑥学术推广费等其他费用:未来年度预测一定的增加额。
其余公司销售费用参照母公司预测方法进行预测。合并整体销售费用预测表详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 销售费用合计 | 6,091.62 | 8,015.84 | 10,139.42 | 11,764.24 | 13,291.87 |
| 占营业收入的比例 | 14.51% | 15.48% | 16.04% | 16.23% | 16.30% |
(6)管理费用预测
唯德康医疗(合并口径)近年经评估非市场化因素调整后管理费用情况如下:
单位:万元
| 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 管理费用 | 3,104.80 | 2,825.37 | 863.22 |
| 占营业收入比例 | 11.50% | 7.55% | 9.35% |
1)唯德康医疗管理费用预测
管理费用中各项费用的分类分析,根据不同费用的发生特点、变动规律进行分析,按照和营业收入的关系、自身的增长规律,采用不同的模型计算:
①折旧:被评估单位管理费用中涉及固定资产可满足现有经营的需求,未来年度按照基准日年化金额预计;
②摊销:按照无形资产及装修等待摊费用的分摊水平预测;
③工资薪酬:被评估单位历史年度的管理人员结构和数量较为稳定,但考虑到标的公司未来业务规模的扩张将增加标的公司整体的管理难度,故本次在考虑平均人员工资薪酬增长的情况下,同时考虑了管理人员数量的增加;
④租赁费:未来年度保持一定比例的增长;
2-2-177
⑤招待费:招待费一般与收入存在一定的对应关系,因此对招待费按照占收入的比例进行预测;
⑥修理费、咨询及服务费、检测费用、保安、保洁费用等:由于其与收入的关联性不大,因此未来年度均保持一定比例的增长;
⑦学术费、其他费用:未来年度预测一定的金额。
其余公司管理费用参照母公司预测方式进行预测。合并整体管理费用预测表详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 管理费用 | 3,295.00 | 3,955.54 | 4,396.95 | 4,822.26 | 5,251.72 |
| 占营业收入比例 | 7.85% | 7.64% | 6.96% | 6.65% | 6.44% |
(7)研发费用预测
唯德康医疗(合并口径)近年经评估非市场化因素调整后研发费用情况如下:
单位:万元
| 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 研发费用 | 1,986.45 | 2,923.12 | 933.72 |
| 占营业收入比例 | 7.35% | 7.81% | 10.12% |
1)对研发费用预测分析如下:
①折旧:被评估单位研发费用中涉及固定资产及无形资产可满足现有经营的需求,未来年度按照2021年年化金额预计;
②工资薪酬:参照销售费用及管理费用的预测模式进行预测;
③租赁费、检验、检测费、研发服务费、水电费、咨询费、差旅交通费:
由于其与收入的关联性不大,因此未来年度均保持一定比例的增长;
④研发材料费:对研发费用中的材料费,本次对其按照历史年度占收入的比例进行预测;
⑤委托研发成本:主要为与子公司图云科技发生的研发业务成本,本次预
2-2-178
测一定的增长率;
⑥其他费用:未来年度预测一定的增加额。
其余公司研发费用参照母公司预测方式进行预测。合并整体研发费用预测表详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 研发费用合计 | 3,498.96 | 4,318.21 | 5,490.21 | 6,319.84 | 7,213.54 |
| 占营业收入的比例 | 8.34% | 8.34% | 8.69% | 8.72% | 8.85% |
(8)财务费用预测
财务费用中,主要为银行存款利息、银行手续费和汇兑损益等。银行存款利息金额较小,因此不予预测;银行手续费出于谨慎性考虑按照基准日年化金额进行测算;对于汇兑损益,考虑到汇率变化的波动性较难判断,本次不予预测。
合并整体财务费用预测表详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 财务费用 | 103.74 | 11.87 | 11.87 | 11.87 | 11.87 |
| 占营业收入比例 | 0.25% | 0.02% | 0.02% | 0.02% | 0.01% |
(9)信用减值损失预测
被评估单位历史年度经评估非市场化因素调整后的信用减值损失情况如下:
单位:万元
| 序号 | 项目\年份 | 2019 | 2020 | 2021年1-3月 |
| 1 | 信用减值损失 | 52.72 | -96.84 | -11.95 |
虽然信用减值损失的发生具有一定的偶然性和不确定性,但本次出于谨慎考虑对未来信用减值损失按照营业收入的一定比例进行测算。
唯德康医疗(合并口径)信用减值损失预测情况如下:
2-2-179
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 信用减值损失 | -62.05 | -77.01 | -94.14 | -107.64 | -120.94 |
| 占营业收入比例 | -0.15% | -0.15% | -0.15% | -0.15% | -0.15% |
(10)其他非经常性损益项目预测
因营业外收入、营业外支出、公允价值变动损益、资产处置收益、资产减值损失、其他收益等非经常性损益具有偶然性,且历年发生额不大,故本次不作预测。
(11)所得税的计算预测
被评估单位及其下属控股子公司适用的所得税税率如下:
| 序号 | 公司名称 | 所得税率/税负率 |
| 1 | 江苏唯德康医疗科技有限公司 | 15.00% |
| 2 | 常州市久虹医疗器械有限公司 | 15.00% |
| 3 | 常州锦福瑞医疗器械有限公司 | 25.00% |
| 4 | 江苏图云医疗科技有限公司 | 25.00% |
根据目前的所得税征收管理条例,业务招待费60%的部分,营业收入的0.5%以内的部分准予税前抵扣,40%的部分和超过0.5%的要在税后列支;研发费用按核定金额可加计100%在税前抵扣。所得税的计算按照该条例的规定计算。
2021年4月8日,为激励企业加大研发投入,支持科技创新,财政部、国家税务总局发布《关于进一步完善研发费用税前加计扣除政策的公告》。文件指出,制造业企业开展研发活动中实际发生的研发费用,未形成无形资产计入当期损益的,在按规定据实扣除的基础上,自2021年1月1日起,可再按照实际发生额的100%在税前加计扣除。
依据上述法律法规文件,本次评估参照被评估单位适用税率及相关税收政策对各单体公司的所得税进行了计算并进行加总,经计算合并口径所得税的计算详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
2-2-180
| 所得税合计 | 1,677.95 | 1,632.29 | 1,914.34 | 2,182.20 | 2,440.18 |
(12)少数股东权益的预测
本次纳入合并报表范围内的公司,除江苏图云医疗科技有限公司为控股子公司以外(持股比例80%),其余公司均为100%全资子公司,本次少数股东权益根据江苏图云医疗科技有限公司的净利润预测情况及股权比例进行预测。合并口径少数股东权益预测详见下表:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 |
| 少数股东权益合计 | 0.08 | 0.92 | 0.93 | 1.71 | 2.56 |
(13)折旧和摊销预测
折旧和摊销的预测,除根据企业原有的各类固定资产和其它长期资产,并且考虑了改良和未来更新的固定资产和其它长期资产。
| 类别 | 折旧年限(年) | 最低残值率 | 年折旧率(%) |
| 房屋及建筑物 | 20.00 | 5.00% | 4.75 |
| 机器设备 | 3-10 | 5.00% | 9.50-31.67 |
| 运输设备 | 4.00 | 5.00% | 23.75 |
| 电子设备 | 3-5 | 5.00% | 19.00-31.67 |
| 固定资产装修 | 3.00 | - | 33.33 |
无形资产的摊销方式如下:
| 项目 | 预计使用寿命 | 依据 |
| 土地使用权 | 50年 | 土地使用权年限 |
| 软件 | 3年 | 预期使用年限 |
(14)资本性支出预测
本处定义的资本性支出是指企业为满足未来经营计划而需要更新现有固定资产设备和未来可能增加的资本支出及超过一年的长期资产投入的资本性支出。
通过对目前预测期销量的可实现性分析,基于被评估单位目前的设备及场
2-2-181
地利用情况,本次将考虑在预测期2021年陆续开始投入设备情况如下:
单位:万元
| 序号 | 项目内容 | 拟建设规划 | 预估不含税金额 |
| 1 | 净化车间扩建 | 4L净化车间设备投入 | 1,000.00 |
| 7A将1L和2L建设成净化车间设备投入 | 1,000.00 | ||
| 2 | 自动产线扩产 | 现有产品自动化生产线设备投入 | 1,000.00 |
| 自动清洗系统 | 200.00 | ||
| 4 | 供应链延伸 | 弹簧延伸设备加清洗加环保500W 塑料件延伸设备加清洗500W | 1,000.00 |
装修的摊销,考虑到公司未来将改造现有位于果香路52号4楼的部分空置厂房用于生产以及未来需要对久虹医疗现有租赁房产的车间进行升级改造,需支付一定的装修费用,本次在唯德康医疗和子公司久虹医疗分别预测200.00万元用于车间的装修工程,未来年度计入长期待摊费用计算,并按照年折旧额的100%计算维护性资本性支出。
土地的摊销,其可使用年限和企业的摊销年限相近,故维持现有生产规模的资本支出摊销与现有水平一致。
(15)营运资金增加额预测
营运资金增加额系指企业在不改变当前主营业务条件下,为保持企业持续经营能力所需的新增营运资金。营运资金的追加是指随着企业经营活动的变化,获取他人的商业信用而占用的现金,正常经营所需保持的现金、存货等;同时,在经济活动中,提供商业信用,相应可以减少现金的即时支付。
生产性企业营运资金主要包括:正常经营所需保持的运营现金、产品存货购置、代客户垫付购货款(应收、预付账款)等所需的基本资金以及应付、预收账款等。通常上述科目的金额与收入、成本呈相对稳定的比例关系,其他应收账款和其他应付账款需具体甄别视其与所估算经营业务的相关性确定(其中与主营业务无关或暂时性的往来作为非经营性)。《评估报告》所定义的营运资金增加额为:
营运资金增加额=当期营运资金-上期营运资金
2-2-182
其中,营运资金=运营现金+应收账款+预付账款+存货-应付账款-预收账款-应付职工薪酬-应交税费运营现金包括两部分:
1)安全运营现金:企业要维持正常运营,需要保有一定数量的现金。该现金一方面需要保证在固定时间必须按时支付的各项开支,如职工薪酬、税金等;另一方面,还要保留一部分现金用于期后的正常营运资金的投入。企业的营运资金不是固定不变的,而是有一定的波动性,安全运营现金的量需要覆盖上述两个情况。
结合分析企业以前年度营运资金的变动情况,根据月付现成本来进行计算。
月完全付现成本=(销售成本+应交税金+三项费用-折旧与摊销)/12
2)限制类资金:限制类资金主要包括企业开具银行承兑汇票、保函等需要在银行交付的一定比例的押金等。该限制类资金会根据开具的应付票据、保函、信用证等金额的大小而变动。另外,部分行业存在向客户收取但使用有明显限制的资金也纳入限制类资金来考虑。该资金不是溢余,也是企业运营资金的一部分。未来根据相应的科目变动而变动。
其他的各个科目的营运资金按照相应的周转率计算。
(16)税后付息债务利息预测
被评估单位基准日无付息债务,标的公司未来无新增付息债务的计划,故本次不予考虑。
(17)折现率的确定
折现率,又称期望投资回报率,是收益法确定评估企业市场价值的重要参数。由于被评估企业不是上市公司,其折现率不能直接计算获得。因此本次评估采用选取对比公司进行分析计算的方法估算被评估企业期望投资回报率。为此,第一步,首先在上市公司中选取对比公司,然后估算对比公司的系统性风险系数β;第二步,根据对比公司平均资本结构、对比公司β以及被评估公司资本结构估算被评估企业的期望投资回报率,并以此作为折现率。
2-2-183
本次采用资本资产加权平均成本模型(WACC)确定折现率。WACC模型是股权期望报酬率和所得税调整后的债权期望报酬率的加权平均值,计算公式如下:
其中:
:债权期望报酬率;:股权期望报酬率;:债务资本在资本结构中的百分比;
:权益资本在资本结构中的百分比;
)(DEDWd
??
)(DE
EW
e
??
:为公司有效的所得税税率。1)股权期望报酬率股权期望报酬率Re按资本资产定价模型(CAPM)确定,计算公式为:
式中:
:无风险利率;:市场风险溢价;:特定风险报酬率;
:评估对象权益资本的预期市场风险系数;
2-2-184
式中:βt为可比公司的预期无杠杆市场风险系数;D、E:分别为可比公司的债务资本与权益资本。CAPM评估师采用以下几步:
①无风险利率
Rf的确定
根据国内外的行业研究结果,并结合《资产评估专家指引第12号——收益法评估企业价值中折现率的测算》的要求,本次无风险利率选择最新的十年期中国国债收益率均值计算。数据来源为中央国债登记结算公司(CCDC)提供的《中国国债收益率曲线》。国债收益率曲线是用来描述各个期限国债与相应利率水平的曲线。中国国债收益率曲线是以在中国大陆发行的人民币国债市场利率为基础编制的曲线。考虑到十年期国债收益每个工作日都有发布,为了避免短期市场情绪波动对取值的影响,结合评估机构的技术规范,按照最新一个完整季度的均值计算,每季度更新一次,本次基准日取值为3.23%。
②市场风险溢价(MRP,即R
m-Rf)的计算
市场风险溢价是指投资者对与整体市场平均风险相同的股权投资所要求的预期超额收益,即超过无风险利率的风险补偿。市场风险溢价通常可以利用市场的历史风险溢价数据进行测算。评估师利用中国证券市场指数的历史风险溢价数据计算得到市场风险溢价。
Rm的计算:根据中国证券市场指数计算收益率。
指数选择:根据《资产评估专家指引第12号——收益法评估企业价值中折现率的测算》,同时考虑到沪深300全收益指数因为修正了样本股分红派息因而比沪深300指数在计算收益率时相对更为准确,评估师选用了沪深300全收益指数计算收益率。基期指数为1000点,时间为2004年12月31日。
时间跨度:计算时间段为2005年1月截至基准日前一年年末。
2-2-185
数据频率:周。考虑到中国的资本市场存续至今为30年左右,指数波动较大,如果简单按照周收盘指数计算,则会导致收益率波动较大而无参考意义。评估师按照周收盘价之前交易日200周均值计算(不足200周的按照自指数发布周开始计算均值)获得年化收益率。
年化收益率平均方法:评估师计算分析了算数和几何两种平均年化收益率,最终选取几何平均年化收益率。
Rf的计算:无风险利率采用同期的十年期国债到期收益率(数据来源同前)。和指数收益率对应,采用当年完整年度的均值计算。
市场风险溢价(MRP,即Rm-Rf)的计算:
评估师通过上述计算得出了各年度的中国市场风险溢价基础数据。考虑到当前我国经济正在从高速增长阶段转向高质量发展阶段,增速逐渐趋缓,因此评估师采用最近5年均值计算MRP数值,如下:
| 期间 | 社会平均收益率 | 十年期国债到期收益率 | |||
| 均值 | 7.00% | ||||
| 2020年 | 9.90% | 2.94% | 6.96% | ||
| 2019年 | 9.87% | 3.18% | 6.69% | ||
| 2018年 | 10.48% | 3.62% | 6.86% | ||
| 2017年 | 10.53% | 3.58% | 6.95% | ||
| 2016年 | 10.38% | 2.86% | 7.52% | ||
即目前中国市场风险溢价约为7.00%。
③贝塔值(β系数)
该系数是衡量委估企业相对于资本市场整体回报的风险溢价程度,也用来衡量个别股票受包括股市价格变动在内的整个经济环境影响程度的指标。由于委估企业目前为非上市公司,一般情况下难以直接对其测算出该系数指标值,故本次通过选定与委估企业处于同行业的可比上市公司于基准日的β系数(即βt)指标平均值作为参照。
综合考虑可比上市公司与被评估企业在业务类型、企业规模、盈利能力、
2-2-186
成长性、行业竞争力、企业发展阶段等多方面的可比性,最终根据同花顺资讯系统(IFIND)中选取的申银万国行业分类-医药生物-医疗器械Ⅲ中所有符合条件的48家上市公司作为可比上市公司,上述公司加权剔除财务杠杆调整平均βt
=0.9338。β系数数值选择标准如下:
标的指数选择:沪深300计算周期:周时间范围:3年收益率计算方法:对数收益率剔除财务杠杆:按照市场价值比D根据基准日的有息负债确定,E根据基准日的股票收盘价对应的市值计算。最后得到评估对象权益资本预期风险系数的估计值βe=0.9338。
④特定风险报酬率ε的确定
评估师在综合考虑委估企业的风险特征、企业规模、业务模式、所处经营阶段、核心竞争力、主要客户及供应商依赖等因素及与所选择的可比上市公司的差异后,主要依据评估人员的专业经验判断后确定。评估师分析判断最终确定特定风险报酬率ε为2.20%。
⑤权益期望报酬率R
e
的确定
最终得到评估对象的权益期望报酬率Re=12.00%
2)债权期望报酬率Rd的确定
债权期望报酬率选取全国银行间同业拆借中心公布的贷款市场报价利率(LPR)-5年期贷款利率。
3)资本结构的确定
2-2-187
结合企业未来盈利情况、管理层未来的筹资策略、被评估企业与可比公司在融资能力、融资成本等方面的差异、资本结构是否稳定等各项因素,本次确定采用企业真实资本结构。
=0.00%
)(DEDWd
??
)(DE
EWe
??
=100.00%4)折现率计算
=12.00%。
(18)股东全部权益价值计算
本次评估的基本模型为:
)(DEEWe
??
DBE??
式中:
E:评估对象的股东全部权益价值;B:评估对象的企业价值;D:评估对象付息债务价值。
DBE??
???
i
CPB
P:评估对象的经营性资产价值;
???
i
CPB??
??????
nnni
ii
rgrgFrFp
????????
?
?
式中:r:所选取的折现率:
资产评估专业人员,在综合考虑评估基准日的利率水平、市场投资收益率
2-2-188
等资本市场相关信息和所在行业、被评估单位的特定风险等相关因素确定折现率。
Fi:评估对象未来第i年的预期收益(现金流);n:明确的预测期期间是指从评估基准日至企业达到相对稳定经营状况的时间。
评估人员在对企业收入结构、成本结构、资本结构、资本性支出、投资收益和风险水平等综合分析的基础上,结合宏观政策、行业周期及其他影响企业进入稳定期的因素,确定预测期。本次明确的预测期期间n选择为5年。根据被评估单位所在行业现状与发展前景、协议与章程约定、经营状况、资产特点和资源条件等,确定预测期后收益期确定为无限期。
g-未来收益每年增长率,根据企业进入稳定期的因素分析预测期后的收益趋势,本次评估假定n年后Fi不变,g取零。
ΣCi:评估对象基准日存在的溢余资产、非经营性资产或负债的价值。
1)经营性资产价值
对纳入报表范围的资产和主营业务,按照最近几年的历史经营状况的变化趋势和业务类型估算预期收益(净现金流量),并折现得到评估对象经营性资产的价值,具体情况如下:
单位:万元
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 | 2026年及以后 |
| 一、营业收入 | 41,974.23 | 51,794.19 | 63,214.78 | 72,467.65 | 81,525.09 | 81,525.09 |
| 减:营业成本 | 16,900.37 | 21,238.51 | 26,080.42 | 29,969.74 | 33,751.25 | 33,751.25 |
| 税金及附加 | 477.77 | 563.07 | 691.25 | 807.14 | 897.35 | 897.35 |
| 销售费用 | 6,091.62 | 8,015.84 | 10,139.42 | 11,764.24 | 13,291.87 | 13,291.87 |
| 管理费用 | 3,295.00 | 3,955.54 | 4,396.95 | 4,822.26 | 5,251.72 | 5,251.72 |
| 研发费用 | 3,498.96 | 4,318.21 | 5,490.21 | 6,319.84 | 7,213.54 | 7,213.54 |
| 财务费用 | 103.74 | 11.87 | 11.87 | 11.87 | 11.87 | 11.87 |
| 加:其他收益 | 100.49 | - | - | - | - | - |
2-2-189
| 项目\年份 | 2021全年 | 2022 | 2023 | 2024 | 2025 | 2026年及以后 |
| 投资收益(损失以“-”号填列) | 126.65 | - | - | - | - | - |
| 净敞口套期收益(损失以“-”号填列) | - | - | - | - | - | - |
| 公允价值变动收益(损失以“-”号填列) | - | - | - | - | - | - |
| 信用减值损失(损失以“-”号填列) | -62.05 | -77.01 | -94.14 | -107.64 | -120.94 | -120.94 |
| 资产减值损失(损失以“-”号填列) | -136.96 | - | - | - | - | - |
| 资产处置收益(损失以“-”号填列) | 0.03 | - | - | - | - | - |
| 二、营业利润 | 11,634.94 | 13,614.14 | 16,310.52 | 18,664.92 | 20,986.55 | 20,986.55 |
| 三、利润总额 | 11,675.80 | 13,614.14 | 16,310.52 | 18,664.92 | 20,986.55 | 20,986.55 |
| 四、所得税 | 1,677.95 | 1,632.29 | 1,914.34 | 2,182.20 | 2,440.18 | 2,440.18 |
| 五、净利润 | 9,997.85 | 11,981.85 | 14,396.19 | 16,482.72 | 18,546.37 | 18,546.37 |
| 六、归属于母公司损益 | 9,997.77 | 11,980.93 | 14,395.26 | 16,481.01 | 18,543.82 | 18,543.82 |
| 其中:基准日已实现母公司净利润 | 2,201.41 | - | - | - | - | - |
| 加:折旧和摊销 | 304.03 | 542.88 | 713.71 | 813.71 | 897.04 | 897.04 |
| 减:资本性支出 | 1,564.99 | 2,304.59 | 1,539.18 | 375.84 | 897.04 | 897.04 |
| 减:营运资本增加 | 560.48 | 1,809.57 | 2,121.32 | 1,705.51 | 1,670.04 | - |
| 七、股权自由现金流 | 5,974.92 | 8,409.65 | 11,448.47 | 15,213.37 | 16,873.78 | 18,543.82 |
| 加:税后的付息债务利息 | - | - | - | - | - | - |
| 八、企业自由现金流 | 5,974.92 | 8,409.65 | 11,448.47 | 15,213.37 | 16,873.78 | 18,543.82 |
| 折现率 | 12.00% | 12.00% | 12.00% | 12.00% | 12.00% | 12.00% |
| 折现期(月) | 4.5 | 15 | 27 | 39 | 51 | |
| 折现系数 | 0.9584 | 0.8679 | 0.7749 | 0.6919 | 0.6178 | 5.1483 |
| 九、收益现值 | 5,726.36 | 7,298.74 | 8,871.42 | 10,526.13 | 10,424.62 | 95,469.15 |
| 经营性资产价值 | 138,316.42 | |||||
2)溢余资产价值经清查:账面货币资金账户存款余额11,748.29万元。经评估人员根据历史
2-2-190
数据分析,企业正常资金周转需要的完全现金保有量为2个月的付现成本费用,除此之外约有7,052.67万元货币资金作为溢余资产。3)非经营性资产价值经过资产清查,被评估单位的非经营性资产和负债的评估价值为1,927.90万元和8,198.14万元,具体情况如下:
单位:万元
| 序号 | 科目名称 | 内容 | 账面价值 | 评估价值 |
| 1 | 其他应收款 | 非经营性往来 | 48.98 | 48.98 |
| 2 | 其他权益工具投资 | 非控股子公司投资 | 44.89 | 44.89 |
| 3 | 其他流动资产 | 待抵扣进项税、预缴所得税等 | 559.34 | 559.34 |
| 4 | 固定资产 | 已处置设备 | 54.02 | 18.21 |
| 5 | 投资性房地产 | 闲置的房屋建筑物 | 79.42 | 202.09 |
| 6 | 递延所得税资产 | 可抵扣暂时性差异 | 103.30 | 103.30 |
| 7 | 其他非流动资产 | 预付设备款 | 284.57 | 284.57 |
| 8 | 货币资金 | 德国公司 | 0.13 | 0.13 |
| 9 | 预付款项 | 预付设备款 | 7.00 | 7.00 |
| 10 | 使用权资产 | 租赁资产 | 659.40 | 659.40 |
| 非经营性资产小计 | 1,841.04 | 1,927.90 | ||
| 1 | 其他应付款 | 非经营性往来、员工激励款 | 269.33 | 7,459.43 |
| 2 | 递延所得税负债 | 应纳税暂时性差异 | 48.04 | 48.04 |
| 3 | 一年内到期的非流动负债 | 办公室租赁费 | 122.29 | 122.29 |
| 4 | 其他流动负债 | 合同负债对应销项税 | 22.48 | 22.48 |
| 5 | 租赁负债 | 租赁负债 | 519.90 | 519.90 |
| 6 | 预计负债 | 专利转让费 | 0.00 | 26.00 |
| 非经营性负债小计 | 982.03 | 8,198.14 |
4)企业价值将所得到的经营性资产的价值、基准日的溢余资产价值、非经营性资产价值代入式,即得到评估对象企业价值。5)股东全部权益价值将评估对象的付息债务的价值代入式,得到评估对象的全部权益价值为:
2-2-191
=139,100.00万元(取整)
(七)评估结论
1、相关评估结果情况
(1)资产基础法评估值
采用资产基础法对企业股东全部权益价值进行评估,得出被评估单位在评估基准日的评估结果如下:
评估基准日,被评估单位股东权益账面值19,383.90万元,评估值33,995.03万元,评估增值14,611.14万元,增值率75.38%。其中:总资产账面值24,084.37万元,评估值38,721.51万元,评估增值14,637.14万元,增值率60.77%。负债账面值4,700.48万元,评估值4,726.48万元,评估增值26.00万元,增值率0.55%。
资产基础法主要增减值情况如下:
单位:万元
DBE??项目
| 项目 | 账面价值 | 评估价值 | 增值额 | 增值率% |
| 流动资产 | 16,619.33 | 17,021.14 | 401.82 | 2.42 |
| 非流动资产 | 7,465.05 | 21,700.37 | 14,235.32 | 190.69 |
| 其中:可供出售金融资产 | - | - | - | - |
| 持有至到期投资 | - | - | - | - |
| 债权投资 | - | - | - | - |
| 其他债权投资 | - | - | - | - |
| 长期应收款 | - | - | - | - |
| 长期股权投资 | 2,860.03 | 3,888.94 | 1,028.91 | 35.98 |
| 其他权益工具投资 | 44.89 | 44.89 | 0.00 | 0.00 |
| 其他非流动金融资产 | - | - | - | - |
| 投资性房地产 | - | - | - | - |
| 固定资产 | 3,762.57 | 6,749.09 | 2,986.52 | 79.37 |
| 在建工程 | - | - | - | - |
| 生产性生物资产 | - | - | - | - |
| 油气资产 | - | - | - | - |
| 使用权资产 | 71.99 | 71.99 | - | - |
2-2-192
| 项目 | 账面价值 | 评估价值 | 增值额 | 增值率% |
| 无形资产 | 493.81 | 10,713.70 | 10,219.89 | 2,069.60 |
| 开发支出 | - | - | - | - |
| 商誉 | - | - | - | - |
| 长期待摊费用 | 4.92 | 4.92 | - | - |
| 递延所得税资产 | 20.49 | 20.49 | - | - |
| 其他非流动资产 | 206.35 | 206.35 | - | - |
| 资产总计 | 24,084.37 | 38,721.51 | 14,637.14 | 60.77 |
| 流动负债 | 4,675.50 | 4,675.50 | - | - |
| 非流动负债 | 24.98 | 50.98 | 26.00 | 104.08 |
| 负债总计 | 4,700.48 | 4,726.48 | 26.00 | 0.55 |
| 净资产(所有者权益) | 19,383.90 | 33,995.03 | 14,611.14 | 75.38 |
主要科目增减值原因分析如下:
1)流动资产流动资产账面值16,619.33万元,评估值为17,021.14万元,增值401.82万元,增值率为2.42%。主要原因是对产成品、发出商品和在产品评估,根据售价,扣除为实现销售所必要的税费进行评估导致的评估增值。2)长期股权投资长期股权投资账面值2,860.03万元,评估值为3,888.94万元,增值1,028.91万元,增值率为35.98%。主要原因是本次对长期股权投资中被投资单位分别评估,并结合持股比例进行测算导致的评估增值。3)固定资产固定资产账面净值3,762.57万元,评估净值为6,749.09万元,增值2,986.52万元,增值率为79.37%,主要系由于近年周边房地产的市场销售价格略有上升,同时固定资产的财务折旧年限与经济耐用年限有差异所致。
4)无形资产无形资产账面价值493.81万元,评估值为10,713.70万元,增值10,219.89万元,增值率为20.70%,主要系由于本次将账面未反映的商标、专利资产组等
2-2-193
纳入评估范围,致使评估增值。
(2)收益法评估值
采用收益法对企业股东全部权益价值进行评估,得出对被评估单位在评估基准日的评估结果如下:
评估基准日,被评估单位在上述假设条件下股东全部权益价值评估值为139,100.00万元,比合并口径经审计后账面归属于母公司股东权益19,585.38万元增值119,514.62万元,增值率610.22%,比母公司单体经审计后账面股东权益19,383.90万元增值119,716.10万元,增值率617.61%。
2、评估结果差异分析及最终评估结论
(1)不同方法评估结果的差异分析
本次评估采用收益法得出的股东全部权益价值为139,100.00万元,比资产基础法测算得出的股东全部权益价值33,995.03万元相差105,104.97万元,差异率为309.18%。主要原因系不同评估方法下的评估结果的差异,其中资产基础法是从企业各项资产现时重建的角度进行估算;而收益法是从企业未来综合获利能力去考虑。
(2)评估结论的选取
根据《资产评估执业准则——企业价值》,对同一评估对象采用多种评估方法时,应当结合评估目的、不同评估方法使用数据的质量和数量,采用定性或者定量的方式形成评估结论。
企业价值除了固定资产、营运资金等有形资源之外,还应包含技术及研发团队优势、服务能力、管理优势等重要的无形资源的贡献。资产基础法的评估结果仅对各单项有形资产和可确指的无形资产进行了价值评估,并不能完全体现各个单项资产组合对整个公司的价值贡献,也不能完全衡量各单项资产间的互相匹配和有机组合因素可能产生出来的企业整体效应价值。标的公司整体收益能力是企业所有环境因素和内部条件共同作用的结果。收益法评估结果的价值内涵包括企业不可辨认的所有无形资产,所以评估结果比资产基础法高。鉴于本次评估目的,收益法评估的途径能够客观、合理地反映评估对象的价值,
2-2-194
故以收益法的结果作为最终评估结论。通过以上分析,评估师选用收益法评估结果作为本次被评估单位股东全部权益价值评估结论。经评估,在评估基准日,上述各项假设条件成立的前提下,被评估单位股东全部权益价值为人民币139,100.00万元。
3、评估结论与账面价值比较变动情况及原因说明
本次评估采用收益法的评估结论,增值的原因如下:
唯德康医疗是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业。标的公司近年经营业绩稳步增长,凭借优质的产品质量和优秀的临床使用效果,标的公司已在内镜诊疗器械行业树立了较高的市场知名度和影响力。本次以标的公司管理层提供的盈利预测为基础进行的收益法测算将企业视为一个有机整体,可以反映标的公司拥有的账面未反映的研发团队优势、服务能力优势和管理能力优势等重要的无形资源价值,因此标的公司股东权益评估价值较账面价值增值较大。
4、股东部分权益价值的溢价(或者折价)以及流动性
本次评估的对象为股东全部权益价值,本次不涉及控股权溢价或者少数股权折价。同时,鉴于市场交易资料的局限性,本次评估结论也未考虑缺乏流动性因素对评估结论的影响。
二、董事会对本次交易评估事项的意见
(一)董事会对评估机构、评估假设前提、评估方法的意见
上市公司董事会对评估机构独立性、评估假设前提合理性、评估方法与评估目的的相关性以及评估定价的公允性发表意见如下:
“1、评估机构的独立性
公司本次交易聘请的上海东洲资产评估有限公司(以下简称“东洲评估”)具有为本次交易提供相关服务的资格。除为本次交易提供评估服务的业务关系
2-2-195
外,东洲评估及其经办评估师与公司、交易对方、标的公司之间不存在其他的关联关系,亦不存在影响其提供服务的现实及预期的利益关系或冲突,具有独立性。
2、评估假设前提的合理性
本次交易的评估机构对标的资产进行评估所采用的假设前提参照了国家相关法律、法规,综合考虑了市场评估过程中通用的惯例或准则,其假设符合标的资产的实际情况,假设前提合理。
3、评估方法与评估目的的相关性
本次评估的目的是确定拟购买资产于评估基准日的市场价值,为本次交易提供价值参考依据。东洲评估对标的公司股东全部权益价值采用收益法和资产基础法进行评估,并最终选择收益法作为评估结果。
评估机构实际评估的资产范围与委托评估的资产范围一致;本次资产评估工作按照国家有关法规与行业规范的要求,遵循独立、客观、公正、科学的原则,按照公认的资产评估方法,实施了必要的评估程序,对标的公司股东全部权益价值在评估基准日的市场价值进行了评估,所选用的评估方法合理,与评估目的相关性一致。
4、评估定价的公允性
本次评估实施了必要的评估程序,遵循了独立性、客观性、科学性、公正性等原则,运用了合规且符合评估资产实际情况的评估方法,选用的参照数据、资料可靠,资产评估价值公允、准确。
本次交易价格以评估值为依据,由各方在公平、自愿的原则下协商确定,资产定价公平、合理,符合相关法律、法规及公司章程的规定,不会损害公司及其股东特别是中小股东的利益。
综上所述,公司本次交易所选聘的评估机构具有独立性,评估假设前提合理,评估方法与评估目的相关性一致,出具的资产评估报告的评估结论合理,评估定价公允。”
2-2-196
(二)估值依据的合理性
标的公司是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业,围绕内镜诊疗领域进行了系统性的产品布局,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求,具备较强的市场竞争力。凭借丰富的产品管线、优质的产品质量及优秀的临床使用效果,在行业内树立了较高的市场知名度和品牌影响力。目前标的公司的营销网络已经基本覆盖全国重点城市,核心产品已销往德国、法国、日本、韩国、英国等五十多个国家和地区。
作为高新技术企业,唯德康医疗始终坚持研发自主创新,积极配合临床医生的使用需求,解决临床手术困惑,并研发了“鲲鹏刀”等系列的创新产品。截至本报告书签署日标的公司已取得国内产品注册及备案证书共计47项,其中三类医疗器械产品注册证书9项,二类医疗器械产品注册证书34项,一类医疗器械产品备案4项,相关核心产品已获得欧盟CE、美国FDA、ISO13485等国内外权威认证。
受益于近年来国家政策支持、国内内镜诊疗器械市场规模增速较快等外部因素,标的公司业绩实现快速增长。标的公司报告期财务状况及盈利能力分析情况详见本报告书“第九节 管理层讨论与分析”之“三、标的公司财务状况及盈利能力分析”,标的公司的行业情况、竞争情况及经营情况详见本报告书“第九节 管理层讨论与分析”之“二、标的公司的行业基本情况”。
从内镜诊疗器械行业来看,根据波士顿科学的统计和预测数据,2018年全球内镜诊疗器械市场规模约为52.2亿美元,2021年预计会达到60.8亿美元,全球内镜诊疗器械市场空间仍有较大的增长潜力。从国内行业发展来看,鉴于我国消化道系统疾病及癌症高发,消化内镜检查的早筛早治仍存在巨大的未被满足的需求,行业前景广阔。
从已获得的经营许可、技术许可来看,标的公司目前主要涉及的经营许可为医疗器械生产许可和各项器械的境内、境外资质认定,除此之外不涉及技术许可使用。考虑到上述经营许可在证照到期后可继续办理续展,在标的公司平稳经营的情况下经营许可的期限对标的公司持续经营能力不构成实质性的影响。
2-2-197
此外,本次交易中,交易对方已对业绩承诺期标的公司的业绩作出承诺,该业绩承诺系补偿义务人基于标的公司目前的经营状况以及对未来市场发展前景和业务规划做出的综合判断。综上所述,本次标的资产估值依据具有合理性。
(三)交易标的后续经营过程中政策、宏观环境、技术、行业、税收优惠等方面的变化趋势及应对措施及其对评估的影响
本次评估是基于现有的国家法律、法规、税收政策、金融政策并基于现有市场情况对未来的合理预测,未考虑今后市场发生目前不可预测的重大变化和波动。本次评估已充分考虑未来政策、宏观环境、技术、行业、税收优惠等方面的发展,未来宏观环境及行业、技术的正常发展变化,不会影响本次标的资产估值的准确性。
(四)评估结果的敏感性分析
1、主营业务收入因素
标的公司维持一定水平的主营业务收入增长率是其评估价值的重要基础之一,如果未来被评估单位主营业务收入增速不达预期、或发生下降的情况,将会对评估价值产生一定影响。主营业务收入变动对标的公司评估价值影响的敏感性分析如下:
| 主营业务收入变化的敏感性分析 | |||||
| 主营业务收入变动率 | -2.00% | -1.00% | - | 1.00% | 2.00% |
| 评估值(万元) | 126,100 | 132,600 | 139,100 | 145,600 | 152,100 |
| 估值变动率 | -9.35% | -4.67% | - | 4.67% | 9.35% |
上述敏感性分析假设除主营业务收入变动因素外,其他因素、数据均不改变。
2、毛利率因素
标的公司维持毛利率稳定是其评估价值的重要基础之一,如果未来标的公司毛利率发生波动,将会对评估价值产生一定影响。具体毛利率变动对标的公司评估价值影响的敏感性分析如下:
2-2-198
| 毛利率变化的敏感性分析 | |||||
| 毛利率变动 | -1.00% | -0.50% | - | 0.50% | 1.00% |
| 评估值(万元) | 132,500 | 135,800 | 139,100 | 142,400 | 145,700 |
| 估值变动率 | -4.74% | -2.37% | - | 2.37% | 4.74% |
上述敏感性分析假设除毛利率变动因素外,其他因素、数据均不改变。
3、折现率因素
折现率是收益法确定标的公司市场价值的重要参数,未来如果用于确定本次评估折现率的参数发生变化,将会导致折现率发生变动,从而对本次评估价值产生一定影响。具体折现率变动对标的公司评估价值影响的敏感性分析如下:
| 折现率变化的敏感性分析 | |||||
| 折现率 | 11.00% | 11.50% | 12.00% | 12.50% | 13.00% |
| 评估值(万元) | 152,600 | 145,600 | 139,100 | 133,200 | 127,700 |
| 估值变动率 | 9.71% | 4.67% | - | -4.24% | -8.20% |
上述敏感性分析假设除折现率变动因素外,其他因素、数据均不改变。
(五)与上市公司的协同效应及其对评估的影响
上市公司专注于抗消化道溃疡、抗肿瘤、抗耐药菌感染、慢性病等领域的产品研发、生产、销售,在中国医药细分市场具有较高的品牌影响力。而标的公司是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业。
本次交易完成后,上市公司将注入医疗器械优质资产,上市公司将利用自身在抗消化药物领域优势,推动整合并共享相关优质医疗资源,充分发挥协同效应,持续提升盈利能力与增强综合竞争力。
但由于本次交易的协同效应难以准确量化,基于谨慎性考虑,本次交易定价未考虑协同效应的影响。
2-2-199
(六)本次交易定价公允性的分析
1、与同行业上市公司比较
标的公司主要从事消化内镜领域医疗器械研发、生产、销售,根据中国证监会发布的《上市公司行业分类指引》(2012年修订),标的公司所属行业为专用设备制造业(C35)。选取行业中与标的公司同处于“专用设备制造业”且主营业务相似的上市公司作为标的公司的可比上市公司,可比上市公司截至本次交易的评估基准日,即2021年3月31日的估值情况如下:
| 证券代码 | 证券简称 | 市盈率(TTM) | 市盈率(LYR) |
| 688029.SH | 南微医学 | 94.75 | 81.25 |
| 300003.SZ | 乐普医疗 | 27.94 | 30.66 |
| 603309.SH | 维力医疗 | 20.96 | 27.06 |
| 688677.SH | 海泰新光 | 67.96 | 67.96 |
| 300529.SZ | 健帆生物 | 77.83 | 106.39 |
| 可比公司平均值 | 57.89 | 62.66 | |
| 可比公司中位数 | 67.96 | 67.96 | |
| 唯德康医疗动态市盈率 | 11.46 | ||
| 唯德康医疗静态市盈率 | 15.65 | ||
数据来源:Wind资讯注1:同行业可比公司市盈率(TTM)=该公司2021年3月31日市值/该公司最新报告期前推12个月(完整年度)的归母净利润注2:同行业可比公司市盈率(LYR)=该公司2021年3月31日市值/该公司2020年归母净利润注3:唯德康医疗动态市盈率=唯德康医疗100%股权作价/2021年至2023年平均承诺净利润注4:唯德康医疗静态市盈率=唯德康医疗100%股权作价/唯德康医疗2020年经审计归母净利润
上述可比公司平均市盈率(TTM)为57.89倍,中位数为67.96倍,平均市盈率(LYR)为62.66倍,中位数为67.96倍。本次交易中,标的公司动态市盈率为11.46倍,静态市盈率为15.65倍,低于可比公司平均值及中值。
2-2-200
2、与同行业可比交易比较
从业务性质及本次交易的可比性角度,选取了2018年以来上市公司收购医疗器械企业的交易案例,其中与本次交易具有相似性的可比交易,其估值情况如下:
| 证券代码 | 证券简称 | 收购标的 | 评估基准日 | 静态PE | 动态PE |
| 300341.SZ | 麦克奥迪 | 麦迪医疗80%股权 | 2017/12/31 | 44.27 | 19.06 |
| 603309.SH | 维力医疗 | 狼和医疗100%股权 | 2017/12/31 | 14.07 | 10.19 |
| 002082.SZ | 万邦德 | 康慈医疗80%股权 | 2018/5/31 | 39.57 | 14.01 |
| 300453.SZ | 三鑫医疗 | 宁波菲拉尔51%股权 | 2018/12/31 | 9.55 | 8.00 |
| 002382.SZ | 蓝帆医疗 | 武汉必凯尔100%股权 | 2019/6/30 | 16.34 | 12.61 |
| 600538.SH | 国发股份 | 高盛生物99.9779%股权 | 2019/12/31 | 15.61 | 12.71 |
| 可比交易平均值 | 23.24 | 12.76 | |||
| 可比交易中位数 | 15.97 | 12.66 | |||
| 002755.SZ | 奥赛康 | 唯德康医疗60%股权 | 2021/3/31 | 15.65 | 11.46 |
数据来源:Wind资讯注1:动态市盈率=交易标的100%股权作价/业绩承诺期平均承诺净利润注2:静态市盈率=交易标的 100%股权作价/业绩承诺期前一年经审计归母净利润
上述可比交易平均静态市盈率为23.24倍,中位数为15.97倍,平均动态市盈率为12.76倍,中位数为12.66倍。本次交易中,标的公司静态市盈率为15.65倍,低于可比交易平均值及中值。动态市盈率为11.46倍,低于与可比交易平均值及中值。
综上,本次交易的评估定价具备公允性,有利于保护中小股东的利益。
(七)评估基准日至重组报告书签署日,标的资产发生的重要变化事项及对交易作价的影响
1、宾得医疗科技(江苏)有限公司
2021年6月,唯德康医疗与HOYA株式会社共同设立宾得医疗科技(江苏)有限公司,其基本情况详见本报告书“第四节 交易标的基本情况”之“四、交易标的下属公司情况”之“(七)宾得医疗科技(江苏)有限公司”。
2-2-201
2、常州市恒可模塑科技有限公司
常州市恒可模塑科技有限公司为唯德康医疗于评估基准日后新设全资子公司,其基本情况如下详见本报告书“第四节 交易标的基本情况”之“四、交易标的下属公司情况”之“(四)常州市恒可模塑科技有限公司”。
考虑到该上述新设主体于基准日后新设立且尚处于筹建期,未来经营状况具有诸多不确定性,因此本次未考虑该事项对评估结论的影响。
除上述情况外,评估基准日至本报告书签署日之间,标的资产不存在可能影响交易作价的重要变化。
(八)交易定价与评估结果的差异说明
本次交易标的资产交易价格以符合《证券法》规定的评估机构出具的资产评估报告确认的评估值为依据,由交易各方协商确认。
以2021年3月31日作为基准日,标的公司100%股权的评估值为139,100.00万元,对应标的公司60%股权评估值为83,460.00万元,经友好协商,双方确定本次交易作价为83,400.00万元。交易定价与评估结果之间不存在较大差异。
三、独立董事对本次交易评估事项的意见
根据《公司法》《证券法》《上市公司重大资产重组管理办法》《创业板上市公司证券发行管理暂行办法》《关于在上市公司建立独立董事制度的指导意见》等有关法律、法规以及《公司章程》的有关规定,上市公司独立董事,本着实事求是、认真负责的态度,基于独立判断的立场,发表独立意见如下:
“1、资产评估机构的独立性
公司本次交易聘请的上海东洲资产评估有限公司(以下简称“东洲评估”)具有为本次交易提供相关服务的资格。除为本次交易提供评估服务的业务关系外,东洲评估及其经办评估师与公司、交易对方、标的公司之间不存在其他的关联关系,亦不存在影响其提供服务的现实及预期的利益关系或冲突,具有独立性。
2、评估假设前提的合理性
2-2-202
本次交易的评估机构对标的资产进行评估所采用的假设前提参照了国家相关法律、法规,综合考虑了市场评估过程中通用的惯例或准则,其假设符合标的资产的实际情况,假设前提合理。
3、评估方法与评估目的的相关性
本次评估的目的是确定拟购买资产于评估基准日的市场价值,为本次交易提供价值参考依据。东洲评估对标的公司股东全部权益价值采用收益法和资产基础法进行评估,并最终选择收益法作为评估结果。
评估机构实际评估的资产范围与委托评估的资产范围一致;本次资产评估工作按照国家有关法规与行业规范的要求,遵循独立、客观、公正、科学的原则,按照公认的资产评估方法,实施了必要的评估程序,对标的公司股东全部权益价值在评估基准日的市场价值进行了评估,所选用的评估方法合理,与评估目的相关性一致。
4、评估定价的公允性
本次评估实施了必要的评估程序,遵循了独立性、客观性、科学性、公正性等原则,运用了合规且符合评估资产实际情况的评估方法,选用的参照数据、资料可靠,资产评估价值公允、准确。
本次交易价格以评估值为依据,由各方在公平、自愿的原则下协商确定,资产定价公平、合理,符合相关法律、法规及公司章程的规定,不会损害公司及其股东特别是中小股东的利益。
综上所述,独立董事认为公司本次交易所选聘的评估机构具有独立性,评估假设前提合理,评估方法与评估目的相关性一致,出具的资产评估报告的评估结论合理,评估定价公允。”
四、基于行业政策的评估影响及模拟测算
(一)带量采购政策
1、带量采购政策进程
2019年7月19日,国务院办公厅印发《治理高值医用耗材改革方案》,明
2-2-203
确“按照带量采购、量价挂钩、促进市场竞争等原则探索高值医用耗材分类集中采购”,并要求国家医保局“鼓励医疗机构联合开展带量谈判采购,积极探索跨省联盟采购”。2020 年 1 月,国家卫生健康委公布《第一批国家高值医用耗材重点治理清单》,包括血管支架、单/多部件金属骨固定器械及附件、可吸收外科止血材料等18项耗材品类。其中可吸收外科止血材料系指“由有止血功能的可降解吸收材料制成,无菌提供,一次性使用”,包括胶原蛋白海绵、胶原海绵、可吸收止血明胶海绵。标的公司产品均未纳入该清单。2020年3月,中共中央国务院《关于深化医疗保障制度改革的意见》指出,“坚持招采合一、量价挂钩,全面实行药品、医用耗材集中带量采购。”
2021年4月, 国家医保局等 8 部委发布《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》,明确基本原则为“一是需求导向、确保质量。根据临床需求,遵循医疗技术发展规律,合理确定集中带量采购的高值医用耗材品种范围,确保质量和供应,满足人民群众基本医疗需求。二是招采合一、量价挂钩。明确采购量,以量换价、确保使用,畅通采购、使用、结算等环节,改革高值医用耗材采购和使用中的不合理因素,治理价格虚高问题。三是因材施策、公平竞争。考虑不同高值医用耗材临床使用特点,功能、技术、使用差异,以及生产供应能力等因素,形成具体采购方案,引导公平竞争。四是部门协同、上下联动。强化部门合作机制,加强对中选产品生产、供应、采购、使用的监督监测,完善激励约束机制,在国家和地方两个层面协同推进高值医用耗材集中带量采购工作。”针对品种覆盖范围明确针对重点将部分临床用量较大、采购金额较高、临床使用较成熟、市场竞争较充分、同质化水平较高的高值医用耗材纳入采购范围,并根据市场销售情况、临床使用需求以及医疗技术进步等因素,确定入围标准。截至重组报告书签署日,高值耗材的全国性带量采购目前涉及冠脉支架及人工关节。
(1)各省针对高值医用耗材的带量采购政策
截至重组报告书签署日,各省市陆续发布并执行了针对高值医用耗材的带
2-2-204
量采购政策,其中针对标的公司销售收入占比较高的省市,如江苏省、浙江省、上海市、山东省、陕西省及河北省,具体情况如下:
| 序号 | 地区 | 政策文件名称 | 发布时间 | 涉及品类 | 是否涉及标的公司产品 |
| 1 | 江苏省 | 《江苏省公立医疗机构部分高值医用耗材组团联盟集中采购方案》 | 2019/7/25 | 血管介入类等高值医用耗材品种 | 否 |
| 《江苏省第二轮公立医疗机构医用耗材组团联盟集中采购公告> | 2019/9/20 | 眼科人工晶体类、血管介入球囊类、骨科人工髋关节类 | 否 | ||
| 《江苏省第三轮公立医疗机构医用耗材组团联盟集中采购公告》 | 2020/8/24 | 腹股沟疝修补片立体片和人工膝关节单髁产品 | 否 | ||
| 《江苏省第四轮公立医疗机构医用耗材联盟带量采购公告》 | 2020/11/19 | 干式胶片(激光、热敏)、吻合器(管型/端端吻合器、痔吻合器、开放直线型切割吻合器及钉匣) | 否 | ||
| 《江苏省第五轮公立医疗机构医用耗材联盟带量采购公告》 | 2021/5/18 | 人工晶体类、冠脉扩张球囊类、双腔起搏器类、冠脉导引导丝类、冠脉导引导管类 | 否 | ||
| 《2021年江苏省关于开展省际联盟冠脉药物涂层球囊带量采购的公告》 | 2021/9/23 | 冠脉药物涂层球囊 | 否 | ||
| 2 | 浙江省 | 《关于发布浙江省公立医疗机构部分医用耗材带量采购的公告》 | 2020/8/7 | 冠脉介入球囊、骨科髋关节 | 否 |
| 《关于发布浙江省公立医疗机构第二批医用耗材集中带量采购的公告》 | 2021/9/23 | 人工晶体、起搏器、微导管、圈套器 | 是,涉及圈套器 | ||
| 3 | 上海市 | 《关于本市做好高值医用耗材(冠脉球囊类)集中采购和使用试点有关工作的通知》 | 2021/7/1 | 冠脉球囊类 | 否 |
| 4 | 山东省 | 《2020年山东省高值医用耗材集中带量采购公告》 | 2021/2/23 | 冠脉介入类快速交换球囊、初次置换人工髋关节、心脏起搏器(双腔) | 否 |
| 《七市采购联盟部分医用耗材带量采购方案》 | 2020/10/14 | 骨科创伤类、血液透析类 | 否 | ||
| 5 | 陕西 省 | 《2020年陕西省公立医疗机构普通医用耗材集中带量采购公告》 | 2020/12/8 | 留置针、泡沫敷料 | 否 |
| 《陕西省医疗保障局陕西省 | 2020/11/3 | 人工晶体 | 否 |
2-2-205
| 序号 | 地区 | 政策文件名称 | 发布时间 | 涉及品类 | 是否涉及标的公司产品 |
| 卫生健康委员会 陕西省药品监督管理局关于公立医疗机构人工晶体带量采购和使用的通知》 | |||||
| 6 | 河北省 | 《关于开展医用耗材一次性使用输液器类、静脉留置针类集中带量采购的通知》 | 2021/3/2 | 一次性使用输液器和静脉留置针 | 否 |
(2)至本回复出具组报告书“第四节意见购久虹医疗再置入上市公司,是否标的公司主要产品纳入带量采购清单的情况目前,集中带量采购政策主要应用于药品及高值耗材领域,意在改革高值医用耗材采购和使用中的不合理因素,治理价格虚高问题。截至重组报告书签署日,标的公司主要产品均未纳入全国性带量采购清单。2021年9月23日,浙江省药械采购中心发布《关于发布浙江省公立医疗机构第二批医用耗材集中带量采购的公告》,采购内容包括人工晶体、起搏器、微导管、圈套器4类医用耗材,系统申报文件时间为2021年9月23日至2021年10月12日。其中圈套器产品系标的公司主要产品之一,包括一次性使用电圈套器及一次性使用息肉切除器,报告期内,标的公司在浙江省销售该类产品情况如下表所示:
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 |
| 圈套器销售收入(万元) | 327.26 | 448.61 | 251.48 |
| 占境内营业收入比例 | 2.58% | 1.92% | 1.60% |
| 占营业收入比例 | 1.50% | 1.20% | 0.93% |
除上述情形外,标的公司主要产品尚未被纳入省级带量采购清单。
2、标的公司主要产品在“带量采购”政策下入围的可能性分析
根据《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》,已取得集中带量采购范围内产品合法资质的医疗器械注册人(备案人),在质量标准、生产能力、供应稳定性、企业信用等方面达到集中带量采购要求的,均可参加带量采购投标程序。
2-2-206
标的公司深耕消化内镜诊疗耗材市场多年,在产品布局、产品质量、销售渠道、品牌建设等方面均具备较强的竞争力。如后续拟针对纳入“带量采购”清单的产品进行投标,标的公司具备入围的竞争优势,具体如下:
(1)品类齐全的产品布局
标的公司围绕消化内镜诊疗领域进行了系统性的产品布局,开发了基础诊断类、止血闭合类、ESD类、ERCP类等四大类子系列产品,能够满足消化内镜诊疗领域的各种临床需求,具备较强的市场竞争力。丰富的产品管线形成了有效的协同效应,较单品类生产企业而言,能够更加有利于抵御行业政策变化和市场竞争态势变化。凭借丰富的产品管线、优质的产品质量及优秀的临床使用效果,标的公司已经在行业内树立了较高的市场知名度和品牌影响力。
(2)高标准的产品质量体系
标的公司高度重视产品的质量控制,通过购置高精度的进口设备,采取先进的生产工艺,使用多种检测手段保证产品质量,现产品研发、注册、采购、生产、销售以及售后服务全流程的覆盖。标的公司的多项核心产品均已取得欧盟CE、ISO13485、韩国KGMP、MDSAP等国内外权威认证。
(3)持续创新的研发体系
消化内镜诊疗器械与临床需求结合度较高。标的公司聚焦消化内镜诊疗领域,以解决临床痛点、提供具备高临床价值的产品为目标,报告期内已经建立起一支行业经验丰富、创新能力突出的研发团队。重组报告书签署日,标的公司合计拥有142项专利。持续创新的研发体系有利于标的公司不断进行产品升级和新产品开发。
(4)完备的营销渠道网络
经过多年的合作和培育,标的公司通过优质的产品服务与经销商及终端客户建立了较为牢固的联系。目前标的公司的营销网络已经基本覆盖全国重点城市,核心产品已销往德国、法国、日本、韩国、英国等五十多个国家和地区。标的公司较为完善的渠道网络使其能更方便地触达临床医生,贴近临床需求,持续保持产品的迭代和升级。
2-2-207
综上所述,标的公司凭借丰富的产品管线、高标准的产品质量体系、持续创新的研发体系及完备的营销渠道网络等具备较强的市场竞争力,如后续拟针对纳入“带量采购”清单的产品进行投标,标的公司具备入围的竞争优势。
3、带量采购可能对标的资产主要产品出厂价格、毛利率、业绩的具体影响,并做敏感性分析
(1)标的资产主要产品市场份额
从市场竞争格局来看,国内消化内镜诊疗市场目前仍由进口品牌占据优势地位,但随着一批国产内镜诊疗耗材企业的快速发展,以南微医学、标的公司为代表的国产品牌,产品性能已经能与国际品牌形成竞争。参考国内上市公司和拟上市公司披露的财务数据和行业情况,国内企业中,南微医学2019年市占率约为18%、标的公司约为4%、安杰思约为3%。标的公司市场占有率处在国内企业前列,已占据良好的市场竞争优势地位,为未来发展奠定扎实市场基础。
图:2019年国内消化内镜器械市场格局
数据来源:公开资料整理
(2)标的公司主要产品毛利率
标的公司消化内镜诊疗器械各品类毛利率情况如下:
| 产品类别 | 2021年1-6月 | 2020年度 | 2019年度 | |||
| 收入占比 | 毛利率 | 收入占比 | 毛利率 | 收入占比 | 毛利率 | |
| 基础诊断类 | 46.18% | 49.61% | 37.78% | 50.01% | 48.69% | 55.29% |
参考数据来源:《南京微创医学科技股份有限公司首次公开发行股票并在科创板上市招股说明书》、《杭州安杰思医学科技股份有限公司首次公开发行股票并在科创板上市招股说明书》
2-2-208
| 产品类别 | 2021年1-6月 | 2020年度 | 2019年度 | |||
| 收入占比 | 毛利率 | 收入占比 | 毛利率 | 收入占比 | 毛利率 | |
| 止血闭合类 | 18.72% | 65.91% | 15.30% | 59.58% | 17.81% | 56.48% |
| ERCP类 | 15.52% | 76.82% | 14.95% | 80.49% | 17.13% | 80.64% |
| ESD类 | 10.09% | 61.95% | 7.94% | 63.94% | 7.68% | 62.99% |
报告期内,标的公司毛利率水平较高且总体保持稳定。同时,标的公司采购的主要原材料为塑料管材、弹簧钢丝、注塑件等,报告期内单价基本稳定,且市场供给较为充足。因此,带量采购政策下标的公司具备一定的利润空间以应对行业政策的变动,拥有入围中标的竞争优势。
2-2-209
(3)标的资产主要产品与国际和国内品牌同类竞品的差异和竞争优势标的公司在消化内镜耗材领域已经初步完成全产品线的覆盖,丰富的产品管线与严格的产品质量控制为标的公司赢得了良好的口碑,与国际及国内品牌同类竞品相比,标的公司主要产品性能已经达到国际及国内知名品牌的同类竞品技术水平。与此同时,标的公司能够凭借更为丰富的产品管线、稳定的产品质量水平、更优秀的临床友好度以及及时的售后服务响应等竞争优势,处于竞争的有利地位。标的公司主要产品与国际和国内品牌同类竞品的差异及竞争优势参见重组报告书之“第四节 交易标的基本情况”之“七、标的公司主营业务情况”之“(四)主要经营模式与核心竞争力”。
2-2-210
(4)对标的资产主要产品业绩的具体影响及敏感性分析
带量采购政策的主要目的系改革高值医用耗材采购和使用中的不合理因素,治理价格虚高问题。依托政策对终端医院最低采购量的要求,可以有效提升入围产品的销量,满足带量采购“以量换价”的核心要求。因此,对于中标企业而言,在一定区域内通过中标的方式降低终端价格,可以带来预期销量的增加。
从价格传导层面,带量采购调整的价格为终端价格并非标的公司的出厂价格。报告期内,标的公司以经销模式为主要销售模式,其出厂价格与终端价格之间已经预留了较为合理的利润空间,因此未来如受带量采购政策影响导致终端价格的下降,终端价格反向传导至标的公司出厂价格的降幅有限。
结合标的公司境内外收入比例、产品结构及“带量采购”进程等因素,考虑“以量换价”的政策影响,本次从销售单价和销售量两个维度对标的公司的业绩及评估进行测算,具体如下:
1)“带量采购”政策下,对整体销售单价的下降幅度测算
鉴于标的公司报告期内境外收入占比较高,因此“带量采购”政策对销售单价的影响集中体现在境内销售部分。考虑政策进程,假定未来5年内,标的公司产品中每年均有20%的产品纳入“带量采购”清单,则整体销售产品出厂均价下降幅度与纳入带量采购清单的主要产品降价幅度勾稽关系如下表所示:
| 纳入“带量采购”产品出厂均价下降幅度 | A | 0% | -10% | -20% | -30% | -40% | -50% |
| 纳入“带量采购”产品情况 | B | 假定未来5年内,标的公司产品中每年均有20%的产品纳入“带量采购”清单 | |||||
| 境内销售产品出厂均价下降幅度 | C=A*B | 0.00% | -2% | -4% | -6% | -8% | -10% |
| 以报告期内外销收入占 营业收入平均比例测算 | D | 40.84% | |||||
| 全部产品出厂均价下降幅度 | E=C*(1-D) | 0.00% | -1.18% | -2.37% | -3.55% | -4.73% | -5.92% |
2)对标的公司毛利率及业绩影响的敏感性分析
基于如上分析,以下将详细分析在带量采购政策下,假设纳入“带量采购”产品出厂均价出现10%、20%、30%、40%及50%的降幅(对应整体销售出厂均价下降幅度约为1.18%、2.37%、3.55%、4.73%及5.92%)情景后产生的影响。
2-2-211
① 带量采购政策对2021年毛利率及业绩的影响
以 2021年公司产品价格及成本为基准,假设带量采购后产品价格按上述比例下降后,对应预期销量的上升,公司产品毛利率情况如下:
| 毛利率情况 | 纳入“带量采购”产品出厂均价下降幅度 | 0% | 10% | 20% | 30% | 40% | 50% | |
| 全部产品出厂均价下降幅度 | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% | ||
| 销量变动 | 纳入“带量采购”产品销量上升幅度 | 0% | 59.74% | 59.25% | 58.76% | 58.25% | 57.74% | 57.20% |
| 整体销量上升幅度 | 0.00% | |||||||
| 纳入“带量采购”产品销量上升幅度 | 10% | 60.21% | 59.73% | 59.24% | 58.74% | 58.23% | 57.70% | |
| 整体销量上升幅度 | 1.18% | |||||||
| 纳入“带量采购”产品销量上升幅度 | 20% | 60.67% | 60.20% | 59.71% | 59.22% | 58.71% | 58.19% | |
| 整体销量上升幅度 | 2.37% | |||||||
| 纳入“带量采购”产品销量上升幅度 | 30% | 61.12% | 60.65% | 60.17% | 59.69% | 59.18% | 58.67% | |
| 整体销量上升幅度 | 3.55% | |||||||
| 纳入“带量采购”产品销量上升幅度 | 40% | 61.56% | 61.10% | 60.62% | 60.14% | 59.65% | 59.14% | |
| 整体销量上升幅度 | 4.73% | |||||||
| 纳入“带量采购”产品销量上升幅度 | 50% | 61.99% | 61.53% | 61.06% | 60.59% | 60.10% | 59.59% | |
| 整体销量上升幅度 | 5.92% | |||||||
② 带量采购政策对预测期(2021年-2025年)毛利率及业绩的影响
| 纳入“带量采购”产品出厂均价下降幅度 | 0% | 10% | ||||||||||
| 全部产品出厂均价下降 | 0.00% | 1.18% | ||||||||||
| 纳入“带量采购”产品销量上升幅度 | 0% | 10% | 20% | 30% | 40% | 50% | 0% | 10% | 20% | 30% | 40% | 50% |
| 整体销量上升 | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% |
| 预测期收入平均变动率 | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% | -1.18% | -0.01% | 1.16% | 2.32% | 3.49% | 4.66% |
| 预测期毛利平均变动率 | 0.00% | 0.81% | 1.61% | 2.39% | 3.15% | 3.89% | -0.83% | -0.01% | 0.80% | 1.58% | 2.35% | 3.10% |
| 预测期合并归母净利润平均变动率 | 0.00% | 4.42% | 8.84% | 13.25% | 17.67% | 22.09% | -4.42% | -0.05% | 4.31% | 8.68% | 13.04% | 17.41% |
| 纳入“带量采购”产品出厂均价下降幅度 | 20% | 30% | ||||||||||
| 全部产品出厂均价下降 | 2.37% | 3.55% | ||||||||||
| 纳入“带量采购”产品销量上升幅度 | 0% | 10% | 20% | 30% | 40% | 50% | 0% | 10% | 20% | 30% | 40% | 50% |
| 整体销量上升 | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% |
| 预测期收入平均变动率 | -2.37% | -1.21% | -0.06% | 1.10% | 2.25% | 3.41% | -3.55% | -2.41% | -1.27% | -0.13% | 1.02% | 2.16% |
| 预测期毛利平均变动率 | -1.69% | -0.85% | -0.04% | 0.76% | 1.54% | 2.30% | -2.56% | -1.72% | -0.89% | -0.09% | 0.70% | 1.47% |
| 预测期合并归母净利润平均变动率 | -8.84% | -4.52% | -0.21% | 4.10% | 8.42% | 12.73% | -13.25% | -8.99% | -4.73% | -0.47% | 3.79% | 8.05% |
2-2-212
| 纳入“带量采购”产品出厂均价下降幅度 | 40% | 50% | ||||||||||
| 全部产品出厂均价下降 | 4.73% | 5.92% | ||||||||||
| 纳入“带量采购”产品销量上升幅度 | 0% | 10% | 20% | 30% | 40% | 50% | 0% | 10% | 20% | 30% | 40% | 50% |
| 整体销量上升 | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% |
| 预测期收入平均变动率 | -4.73% | -3.61% | -2.48% | -1.35% | -0.22% | 0.90% | -5.92% | -4.80% | -3.69% | -2.58% | -1.46% | -0.35% |
| 预测期毛利平均变动率 | -3.46% | -2.61% | -1.77% | -0.95% | -0.16% | 0.62% | -4.38% | -3.51% | -2.67% | -1.84% | -1.03% | -0.24% |
| 预测期合并归母净利润平均变动率 | -17.67% | -13.46% | -9.25% | -5.05% | -0.84% | 3.37% | -22.09% | -17.93% | -13.78% | -9.62% | -5.46% | -1.31% |
③ 带量采购政策对评估值的影响
以下的敏感性分析是基于这个预测的基础上进一步预测单价下降的影响的。评估结论测算结果如下:
单位:亿元
| 评估结论敏感性分析 | 带量采购产品出厂均价下降幅度 | 0% | 10% | 20% | 30% | 40% | 50% |
| 全部产品出厂均价下降幅度 | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% | |
| 带量采购销量上升 | 整体销量上升 | 估值结论 | |||||
| 0% | 0.00% | 13.91 | 13.24 | 12.57 | 11.9 | 11.23 | 10.56 |
| 10% | 1.18% | 14.58 | 13.9 | 13.23 | 12.55 | 11.87 | 11.19 |
| 20% | 2.37% | 15.25 | 14.56 | 13.88 | 13.19 | 12.51 | 11.82 |
| 30% | 3.55% | 15.92 | 15.22 | 14.53 | 13.84 | 13.15 | 12.45 |
| 40% | 4.73% | 16.59 | 15.89 | 15.18 | 14.48 | 13.78 | 13.08 |
| 50% | 5.92% | 17.26 | 16.55 | 15.84 | 15.13 | 14.42 | 13.71 |
差异率测算如下:
| 评估结论差异率敏感性分析 | 带量采购产品出厂均价下降幅度 | 0% | 10% | 20% | 30% | 40% | 50% |
| 全部产品出厂均价下降幅度 | 0.00% | 1.18% | 2.37% | 3.55% | 4.73% | 5.92% | |
| 带量采购销量上升 | 整体销量上升 | 估值结论差异率 | |||||
| 0% | 0.00% | 0.00% | -4.82% | -9.63% | -14.45% | -19.27% | -24.08% |
| 10% | 1.18% | 4.82% | -0.07% | -4.89% | -9.78% | -14.67% | -19.55% |
| 20% | 2.37% | 9.63% | 4.67% | -0.22% | -5.18% | -10.06% | -15.03% |
| 30% | 3.55% | 14.45% | 9.42% | 4.46% | -0.50% | -5.46% | -10.50% |
| 40% | 4.73% | 19.27% | 14.23% | 9.13% | 4.10% | -0.93% | -5.97% |
| 50% | 5.92% | 24.08% | 18.98% | 13.87% | 8.77% | 3.67% | -1.44% |
2-2-213
如上表所述,若未来纳入带量采购清单产品出厂均价的下降会引致估值的下降,但同时带来的预期销量的上升将对应抵消估值的下降幅度。当预期销量增幅较高时,估值出现正向增长态势。
(二)“两票制”政策
1、“两票制”政策进程
“两票制”政策是指医疗器械生产企业到流通企业开一次发票,流通企业到医疗机构开一次发票。
2018年3月,国家卫生和计划生育委员会等部门印发了《关于巩固破除以药补医成果持续深化公立医院综合改革的通知》,要求逐步推行高值医用耗材购销“两票制”。
截至本报告书签署日,“两票制”政策尚未在全国范围内推开。报告期内,标的公司产品仅在安徽、陕西、福建和新疆等省份的公立医院采用“两票制”进行销售。
2、标的公司在实行“两票制”和尚未实行“两票制”的下的销售模式
在尚未实行“两票制”的地区,公司销售采用普通经销模式,即经销商将承担一定的市场开发及销售拓展职责,标的公司负责向经销商进行产品知识培训,提供必要的技术支持,因此出厂价相对较低。
在实行“两票制”的地区,公司销售采用配送经销模式,即配送商一般只承担产品的配送及物流工作,由标的公司承担市场推广职能,因此出厂价相对较高。
3、标的公司在实行“两票制”和尚未实行“两票制”的营业收入、销售费用和毛利率情况
报告期内,标的公司在实行“两票制”和尚未实行“两票制”区域的营业收入、销售费用和毛利率情况分别如下表所示。由于标的公司销售费用主要由市场推广费、职工薪酬、运输费和办公差旅招待费组成,其中职工薪酬、市场推广费中学术会议等展会费用系标的公司基于当年的市场推广策略整体实施,无法以“两票制”地区及非“两票制”地区进行准确拆分,因此针对已实行“两
2-2-214
票制”政策的地区,销售费用以因“两票制”政策新增的销售费用进行测算,具体如下:
| 项目\年度 | 2021年1-6月 | 2020年 | 2019年 | |
| 尚未实行“两票制” | 非两票制营业收入(万元) | 11,605.99 | 16,432.18 | 14,028.68 |
| 非两票制营业成本(万元) | 4,401.46 | 5,770.64 | 4,375.13 | |
| 非两票制毛利率 | 62.08% | 64.88% | 68.81% | |
| 已实行“两票制” | 两票制营业收入(万元) | 941.42 | 2,566.68 | 1,536.97 |
| 两票制营业成本(万元) | 82.03 | 213.32 | 141.25 | |
| 因“两票制”政策新增的销售费用金额(万元) | 582.39 | 1,602.32 | 967.26 | |
| 因“两票制”政策新增的销售费用率 | 61.86% | 62.43% | 62.93% | |
| 两票制毛利率 | 91.29% | 91.69% | 90.81% | |
| 两票制销售扣除销售费用后毛利率 | 64.27% | 68.50% | 70.99% | |
| “非两票制销售扣除销售费用后毛利率”与“两票制销售毛利率”差异 | 2.19% | 3.62% | 2.17% | |
注:两票制销售扣除费用后毛利率=(两票制销售金额-两票制销售成本-两票制销售费用金额-标的公司额外承担的税费)/(两票制销售金额-两票制销售费用金额-标的公司额外承担的税费)
报告期内,标的公司产品仅在安徽、陕西、福建和新疆等省份的部分公立医院采用“两票制”进行销售,因此已实行“两票制”的营业收入占总营业收入的比重相对较小。报告期各期,已实行“两票制”模式销售产品的销售收入分别为1,536.97万元、2,566.68万元、941.42万元,占营业收入总额的比例分别为5.69%、6.86%和4.32%。
相较于尚未实行“两票制”区域而言,由于在“两票制”下相应的市场推广职能由标的公司承担,故其出厂价格及市场推广费用有所提高,继而导致营业收入及毛利率相应提升,同时销售费用相应增加。
经测算报告期内公司实行“两票制”销售扣除费用后毛利率与尚未实行“两票制”模式销售区域毛利率差异较小。
4、标的资产具备足够的销售能力应对“两票制”的全面推行
为了应对“两票制”未来所可能产生的影响,标的公司已经制定并采取了相应措施进行应对:
2-2-215
(1)设立专业化的销售平台公司。锦福瑞医疗设立于2017年,目前为唯德康医疗的全资子公司,锦福瑞医疗设立的初衷即作为销售平台公司,同时统筹管理唯德康医疗和久虹医疗在境内的销售业务,在报告期内锦福瑞医疗的经营状况良好,营业收入呈逐年上升趋势。
(2)加大对营销网络建设的投入力度,扩充营销队伍,并进一步提高公司销售服务水平及业务拓展能力。
标的公司为应对未来市场竞争加剧和“两票制”区域扩大的可能性,也制定了扩大和优化销售团队的相应计划,具体情况如下:
| 项目\年度 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 | |
| 唯德康医疗 | 销售人员数量 | 19 | 21 | 23 | 25 | 27 |
| 增加额 | - | 2 | 2 | 2 | 2 | |
| 久虹医疗 | 销售人员数量 | 57 | 60 | 65 | 68 | 71 |
| 增加额 | - | 3 | 5 | 3 | 3 | |
| 锦福瑞医疗 | 销售人员数量 | 11 | 21 | 31 | 36 | 41 |
| 增加额 | - | 10 | 10 | 5 | 5 | |
| 合计 | 销售人员数量 | 87 | 102 | 119 | 129 | 139 |
| 增加额 | - | 15 | 17 | 10 | 10 | |
标的公司实际销售团队主要分为十个销售大区,截至2021年6月30日,标的公司销售人员规模为81人。本次预测2021年平均销售人员数量合计为87人,高于目前标的公司实际销售团队规模。
(3)与大型医疗器械配送商合作,并陆续将市场推广服务交由给相应的第三方服务机构,以应对“两票制”下业务推广方式的变化。
5、“两票制”全面推行对本次评估的影响
假设在全面推行“两票制”的情况下由于经销环节的缩减,企业的毛利会有所上升,与此同时销售费用也会由于经销模式从普通经销模式转向配送模式,使得企业销售费用有所增加。
(1)因业务模式变化带来的委托推广费用的增加
在全面推行“两票制”的情况下,经销模式从普通经销模式转向配送模式,
2-2-216
标的公司会通过聘请第三方专业推广商的形式协助其进行市场推广,因此委托推广会带来一部分销售费用的上升。以标的公司现有“两票制”地区的销售情况为基础,报告期内,“非两票制销售扣除销售费用后毛利率”与“两票制销售毛利率”差异分别为2.17%、3.62%和2.19%,差异率较小。因此,“两票制”地区因业务模式变化带来的销售费用的上升与销售收入的上升总体能够抵消,从而对于标的公司的净利润不会产生明显的影响。预计“两票制”全面推行后,对本次评估无实质性影响。
(2)因业务模式变化带来的自行推广费用的增加
考虑到“两票制”政策下,标的公司需直接维护的终端医疗机构有所增加,预期会增加一部分自行推广费用。本次评估对于标的公司的销售费用预测中针对这一因素也进行了考虑,具体预测过程如下。
(3)市场推广费预测中对“两票制”影响的考虑
1)“两票制”未来在医疗器械领域的推广尚存不确定性
2016年12月26日,国务院深化医药卫生体制改革领导小组办公室联合国家卫计委等多部委发布了《关于在公立医疗机构药品采购中推行“两票制”的实施意见(试行)的通知》,各省自主决定是否在医疗器械领域执行“两票制”政策。2018年3月5日,国家卫计委、财政部、人社部、发改委、中医药管理局、医改办联合印发《关于巩固破除以药补医成果持续深化公立医院综合改革的通知》(国卫体改发[2018] 4号)中提出,逐步推行高值医用耗材购销“两票制”。目前,“两票制”主要在药品流通领域推广,医疗器械领域的“两票制”暂未在全国范围推广。未来“两票制”在全国范围内的推广进度和可能性尚未有明确的法规和意见出台。因此“两票制”模式对医疗器械领域内公司未来销售费用及销售模式的影响仍存在不确定性。
2)执行“两票制”模式对标的公司销售利润的影响有限
在“两票制”推行之前,公司市场推广、医院开发、临床和售后服务等工作主要由专业的医疗器械经销商完成,因此公司产品出厂价和销售费用率均较低。在“两票制”实施之后,由于流通企业仅提供集中配送服务,公司将市场推广服务外包给相应的第三方服务机构,将会形成较高销售费用,但公司产品
2-2-217
的销售价格也相应提高,营业收入随之增长,最终对于公司整体销售净利润的影响有限。3)境内外业务并重降低“两票制”模式对公司销售费用的影响报告期内,标的公司境内销售与境外销售并重,2019年度、2020年度和2021年1-6月,标的公司境外业务收入占主营业务收入总额的比例为41.92%、37.55%和41.83%,占比较为稳定。而境外主要为贴牌业务,即根据客户的要求,负责提供从研发、设计、生产到后期维护的全部服务,而最终产品贴上客户的商标且由客户负责销售。在此情况下,公司境外销售业务所发生的销售费用较少,同时并不受境内相关政策变化的影响。4)收益法评估盈利预测中对市场推广费的预测方式本次收益法评估在谨慎考虑产品销售单价下降的情况下,同时保持市场推广相关费用预测金额和占比的上升,其中针对“两票制”政策的具体考量如下:
标的企业为应对“两票制”政策,存在销售模式的转变,将逐步与大型医疗器械配送商合作,并陆续将市场推广服务交予专业的第三方服务机构进行推广,为此,在唯德康医疗、久虹医疗和锦福瑞医疗单体在销售费用预测中,均增加了学术推广费和市场宣传费的支出预计,具体如下:
单位:万元
| 项目\年度 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 | |
| 唯德康医疗 | 会务费 | 215.76 | 341.81 | 498.53 | 670.25 | 866.66 |
| 业务宣传费 | 34.06 | 100.48 | 191.64 | 300.87 | 340.18 | |
| 学术推广费 | 10.00 | 110.00 | 190.00 | 230.00 | 270.00 | |
| 市场推广相关费用合计 | 259.82 | 552.29 | 880.17 | 1,201.12 | 1,476.84 | |
| 增长率 | 113% | 59% | 36% | 23% | ||
| 占营业收入比例 | 1.44% | 2.41% | 3.17% | 3.75% | 4.08% | |
| 久虹医疗 | 学术推广费 | 450.00 | 600.00 | 700.00 | 750.00 | 770.00 |
| 咨询费 | 307.15 | 313.29 | 319.56 | 325.95 | 332.47 | |
| 会务费 | 654.79 | 1,090.59 | 1,650.70 | 1,972.50 | 2,314.12 | |
| 市场推广相关费用合计 | 1,411.94 | 2,003.88 | 2,670.26 | 3,048.45 | 3,416.59 | |
| 增长率 | 42% | 33% | 14% | 12% | ||
2-2-218
| 项目\年度 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 | |
| 占营业收入比例 | 7.12% | 7.90% | 8.58% | 8.58% | 8.57% | |
| 锦福瑞医疗 | 会务费 | 800.00 | 1,100.00 | 1,350.00 | 1,550.00 | 1,650.00 |
| 市场推广相关费用合计 | 800.00 | 1,100.00 | 1,350.00 | 1,550.00 | 1,650.00 | |
| 增长率 | 38% | 23% | 15% | 6% | ||
| 占营业收入比例 | 3.32% | 3.78% | 3.80% | 3.84% | 3.65% | |
| 合并口径市场推广相关费用合计 | 2,471.76 | 3,656.17 | 4,900.43 | 5,799.57 | 6,543.43 | |
| 增长率 | - | 48% | 34% | 18% | 13% | |
| 占合并营业收入比例 | 5.89% | 7.06% | 7.75% | 8.00% | 8.03% | |
除此之外,标的公司为应对未来市场竞争加剧和“两票制”区域扩大的可能性,也制定了扩大和优化销售团队的相应计划,具体情况如下:
| 项目\年度 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 | |
| 唯德康医疗 | 销售人员数量 | 19 | 21 | 23 | 25 | 27 |
| 增加额 | - | 2 | 2 | 2 | 2 | |
| 久虹医疗 | 销售人员数量 | 57 | 60 | 65 | 68 | 71 |
| 增加额 | - | 3 | 5 | 3 | 3 | |
| 锦福瑞医疗 | 销售人员数量 | 11 | 21 | 31 | 36 | 41 |
| 增加额 | - | 10 | 10 | 5 | 5 | |
唯德康医疗预测期内合并口径销售费用预测及占比情况如下:
| 项目\年度 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 |
| 合并销售费用预测(万元) | 6,091.62 | 8,015.84 | 10,139.42 | 11,764.24 | 13,291.87 |
| 占合并口径营业收入比例 | 14.51% | 15.48% | 16.04% | 16.23% | 16.30% |
预测期销售费用增长率与销售收入增长率预测情况对比:
| 项目\年度 | 2021年 | 2022年 | 2023年 | 2024年 | 2025年 |
| 合并销售费用增长率 | 28.82% | 31.59% | 26.49% | 16.02% | 12.99% |
| 合并营业收入增长率(剔除口罩业务) | 34.01% | 23.40% | 22.05% | 14.64% | 12.50% |
| 差异 | -5.19% | 8.19% | 4.44% | 1.39% | 0.49% |
上表数据中,除预测期首年外,未来年度每年销售费用预测增长率均高于营业收入的增长率。
2-2-219
唯德康医疗预测期销售费用与医疗器械行业上市公司销售费用率比较情况如下:
| 项目\年度 | 销售费用率 |
| 预测期末销售费用率 | 16.30% |
| 可比公司2020年平均销售费用率 | 15.69% |
| 医疗器械行业上市公司2020年平均销售费用率 | 16.27% |
数据来源:同花顺IFND金融终端(申银万国行业分类-医疗器械III)
通过上述两方面的措施及分析计算,在保持公司产品销售单价下降的基础上,预测期内公司整体销售费用金额及占主营业务收入的比例保持持续上升,综合考虑了“两票制”政策影响、未来的市场推广安排等对公司销售费用的影响,不存在高估预测期利润的情况。
(三)医保政策
1、“医保”政策情况
根据国家医疗保障局于2020年6月发布的《基本医疗保险医用耗材管理暂行办法(征求意见稿)》的相关规定,“第三条 【准入管理】国务院医疗保障行政部门综合考虑医用耗材的功能作用、临床价值、费用水平、医保基金承受能力等因素,采用准入法制定《基本医疗保险医用耗材目录》(以下简称《基本医保医用耗材目录》)并定期更新,动态调整。《基本医保医用耗材目录》内医用耗材按规定纳入医保基金支付范围”.纳入《基本医保医用耗材目录》的医用耗材方可进行医保报销支付,其中纳入基本医疗保险支付范围的医用耗材,应当是按规定在药监部门注册或备案,同时具备临床必需、安全、有效、经济等基本条件的医用耗材。
目前国家尚未针对医用耗材制定统一的医保目录,针对医疗器械医保支付情况主要参照国家医疗保障局制定的基本医疗保险诊疗项目,各省市地区在国家目录的基础上制定本省的基本医疗保险诊疗项目目录,因此,不同地区的医保资金结算比例、结算方式存在一定的差异。
2、“医保”政策对标的公司经营业绩及本次评估的影响
(1)报告期内医保范围内销售收入及占比
2-2-220
报告期内,标的公司纳入各地医保地区医保名录范围内的主要产品销售收入情况如下:
单位:万元
| 项目 | 计算 过程 | 2019年 | 2020年 | 2021年1-6月 |
| 医保范围内收入 | A | 10,885.75 | 12,241.13 | 9,154.73 |
| 境内销售收入(扣除口罩业务) | B | 15,674.02 | 19,143.21 | 12,687.70 |
| 占比 | C=A/B | 69.45% | 63.95% | 72.15% |
| 合并营业收入 | D | 27,008.99 | 37,412.50 | 21,826.15 |
| 占比 | E=A/D | 40.30% | 32.72% | 41.94% |
报告期内,标的公司产品进入各地方医保名录范围内销售的产品收入占标的公司境内销售收入(扣除口罩业务)比例分别为69.45%、63.95%及72.15%,占比较高。
(2)报告期内医保地区及非医保地区毛利率差异
由于医疗器械耗材的采购,在大多数省份通过阳光采购平台挂网或集中招标等形式进行,其挂网价或招标价与是否进入医保通常无关,故标的公司主要产品纳入医保名录范围内区域和医保范围外的出厂价基本一致,因此医保范围内与医保范围外的产品销售的毛利率基本无差异。
(3)医保降费对本次收益法估值的敏感性分析
由于医保范围内及医保范围外的产品出厂价格基本一致,故本次假设预测期内标的公司境内产品全部纳入医保范围,预测标的公司预测期医保控费导致境内营业收入对应下降幅度分别为3%、6%和9%,同时保持营业成本及其他预测参数不变的情况下,营业收入下降对本次评估值的敏感性分析如下:
| 医保控费导致 境内营业收入对应下降幅度 | 0% | 3% | 6% | 9% |
| 外销收入占营业收入平均比例 | 40.84% | |||
| 整体营业收入下降幅度 | 0.00% | -1.77% | -3.55% | -5.32% |
| 评估值(万元) | 139,100.00 | 129,100.00 | 119,000.00 | 109,000.00 |
| 差异率 | - | -7.19% | -14.45% | -21.64% |
由上表可知,医保控费下降幅度越大,对公司的估值下降影响幅度越大。未来如在医保控费下,标的公司整体产品均价大幅下降,则估值同步将有所下
2-2-221
降。
(四)结合行业政策,本次收益法评估对标的公司预测的合理性分析
1、近期各地最新出台的医疗器械集采政策及对标的资产的盈利能力影响情况总体而言,集中带量采购政策的主要目的系改革高值医用耗材采购和使用中的不合理因素,压缩中间环节不合理利润,从价格传导层面,集中带量采购调整的价格为终端价格并非标的公司的出厂价格。同时,依托政策对终端医院最低采购量的要求,可以有效提升入围产品的销量,满足集中带量采购“以量换价”的核心要求。因此,医疗器械集采政策的推进不会对标的资产盈利能力产生重大不利影响。
2、本次收益法评估中对标的公司产品销售量、销售价格的评估预测依据
本次收益法评估中对标的公司主要类别的产品销售量进行了分类预测,对于上述各类产品的销售单价变动率采用了一致的价格变动预测率。
由于标的公司产品型号类型较多,本次以标的公司主营业务收入占比最高的基础诊断类产品进行举例分析如下:
(1)基础诊断类单价的预测
基础诊断类产品主要包括:一次性使用活体取样钳、内窥镜用异物钳、医用球囊压力泵、一次性使用息肉切除器、活检阀、清洁刷、食道贲门狭窄扩张器等细分类别产品。
1)2021年销售单价的预测
基础诊断类产品2019年、2020年和2021年1-3月的加权平均单价分别为
15.09元、15.97元、16.45元,呈现小幅上升趋势。本次评估以2021年1-3月的加权平均单价16.45元为基础,预计2021年全年将维持该单价水平,并以此为基础对2022年及以后年度进行预测。
2)2022年及以后年度销售单价的预测
2022年以后销售单价整体预测情况如下:
2-2-222
| 序号 | 项目\年份 | 2021 | 2022 | 2023 | 2024 | 2025 |
| 1 | 销售单价(元/件) | 16.45 | 15.63 | 14.85 | 14.11 | 13.97 |
| 2 | 增长率 | / | -5.00% | -5.00% | -5.00% | -1.00% |
| 3 | 复合变动率 | -4.02% | ||||
本次盈利预测按产品单价分年度逐步下降进行预测,即预测2022年至2024年基础诊断类产品平均单价每年下降5%,永续期前下降幅度为1%,经计算复合增长率为-4.02%。
本次收益法评估并对基础诊断类产品预测单价按每年下降 5%进行预测主要基于以下原因:
① 历史年度单价较为稳定
标的公司基础诊断类产品主要包括一次性使用活体取样钳、一次性使用细胞刷、异物钳等,报告期内标的公司基础诊断类平均销售价格情况如下表,基础诊断类产品的平均单价较为稳定,2021 年 1-6 月基础诊断类产品单价相较于2019年度同类产品单价复合变动率为2.03%。
| 序号 | 产品类别 | 2021年1-6月 | 2021年1-3月 | 2020年度 | 2019年度 |
| 1 | 基础诊断类(元/件) | 20.23 | 19.56 | 20.33 | 19.63 |
| 2 | 变动率 | -0.49% | -3.79% | 3.56% | - |
| 3 | 复合变动率 | 2.03% | |||
② 新产品上市将进一步优化基础诊断类产品价格结构
标的公司目前基础诊断类在研产品丰富,拥有较好的技术储备,基础诊断类部分在研项目如下:
| 项目名称 | 拟达到的目标 | 与行业主要技术的比较 |
| 内窥镜用球囊导管 | 本产品用于安装在内窥镜先端部,以保持适当的内镜视野 | 保障视野同时,可对消化道狭窄扩张、辅助异物取出 |
| 一次性可旋转活检钳 | 供消化道内窥镜下活组织取样或钳取和清除异物用 | 增加了旋转功能,操作更加精确、简单,产品规格更加全面 |
| 内窥镜用球囊导管 | 对消化道狭窄临时扩张 | 更大的扩张直径,可临时起到封堵作用 |
| 内窥镜超细活检钳 | 用于供胆道、消化道、呼吸道、组织取样或清除异物用 | 更宽的器械通道,超长长度下钳头能顺利开合 |
上述产品预计将于 2021 年至 2022 年陆续获得必要的上市前资质审批。
2-2-223
考虑到新产品由于技术迭代而具有更好的产品性能,通常上市初期的销售单价也将略高于前一代产品。随着未来新产品逐步上市,在现有市场条件下将对基础诊断类产品的平均单价起到稳定作用。
③ 多元的销售区域降低因政策带来的降价风险
报告期内,标的公司产品在境内外均有销售,其中境外收入比例分别为(扣除口罩业务)比例分别为41.92%、38.84%及41.83%。考虑到标的公司与境外主要客户均建立了长期良好的合作关系且报告期内贴牌销售产品单价均保持了较为稳定的趋势。标的公司丰富的销售区域将有效降低未来国内相关政策执行时间和执行范围不确定的影响。
(2)基础诊断类销售数量的预测
1)销量预测与历史销量增长率较为匹配
唯德康医疗合并口径基础诊断类历史年度增长率情况如下表:
单位:万件
| 项目 | 2021年1-6月 | 2021年1-3月 | 2020年 | 2019年 |
| 基础诊断类销量 | 498.07 | 218.09 | 695.01 | 669.48 |
| 增长率 | - | - | 3.81% | - |
唯德康医疗合并口径基础诊断类产品销量保持小幅增长,2020年未能呈现快速增长主要原因系受新冠疫情影响导致的就诊患者下降所致。2021年1-6月,基础诊断类产品已呈现明显上升趋势,当期已实现销售数量为498.07万件,约占2020年全年的比例为71.66%。
① 同比增速情况
2021年1-6月唯德康医疗合并口径基础诊断类产品销售收入与2019年及2020年同期对比情况如下:
| 项目 | 2021年1-6月 | 2020年1-6月 | 2019年1-6月 |
| 基础诊断类销售收入(万元) | 10,074.95 | 6,186.67 | 6,132.00 |
| 基础诊断类销量(万件) | 498.07 | 340.15 | 317.71 |
| 销量增长率 | 46.43% | 7.06% | - |
2021年1-6月唯德康医疗合并口径销量较2020年同期增速为46.43%,较2019年同期增速为56.77%,均超过40%。
2-2-224
② 环比增速情况
2020年各季度及2021年前两季度,基础诊断类产品销售收入和销售数量情况如下:
| 项目 | 2020年 一季度 | 2020年 二季度 | 2020年 三季度 | 2020年 四季度 |
| 基础诊断类销售收入(万元) | 2,939.87 | 3,246.80 | 3,678.42 | 4,262.42 |
| 基础诊断类销量(万件) | 169.81 | 170.33 | 147.16 | 207.70 |
| 项目 | 2021年一季度 | 2021年二季度 | ||
| 基础诊断类销售收入(万元) | 4,417.12 | 5,657.83 | ||
| 基础诊断类销量(万件) | 222.98 | 275.08 | ||
2021年一、二季度合计销量为498.07万件,相比2020年三、四季度合计销量环比增长40.36%。按此环比增长率计算,2021年全年预计销量及与本次收益法评估预测销售量的比对情况如下:
| 项目 | 增长率/数量(万件) |
| 2020年3、4季度销售量 | 354.85 |
| 2021年1、2季度销售量 | 498.07 |
| 环比增长率 | 40.36% |
| 按环比增长率预估2021年全年销售量 | 1,197.16 |
| 本次收益法预测2021年唯德康医疗+久虹医疗销售量 | 974.17 |
综上,基础诊断类产品历史年度增长率除2020年受到新冠疫情影响有所放缓外,2020年至今各期环比增长率及同期增长率均保持良好的增长态势,本次预测数据与其具有较好的匹配性。
2)2021年上半年销售情况
根据标的公司2021年1-6月相关数据,唯德康医疗合并口径已实现基础诊断类产品销售数量498.07万件,占全年预测量的51.13%,唯德康医疗和久虹医疗单体合计不含税销售金额为9,378.90万元,占全年预测金额的53.74%,产品销售完成情况良好。
① 销售量情况
| 项目 | 数量(万件)/占比 |
| 2021年1-6月销售量 | 498.07 |
| 2021年全年预测销售量 | 974.17 |
| 完成度 | 51.13% |
2-2-225
② 销售金额情况
| 项目 | 不含税销售金额(万元) |
| 久虹医疗2021年1-6月基础诊断类销售额 | 4,450.90 |
| 唯德康医疗2021年1-6月基础诊断类销售额 | 4,928.00 |
| 合计 | 9,378.90 |
| 久虹医疗2021年预测销售额 | 9,777.82 |
| 唯德康医疗2021年预测销售额 | 7,675.01 |
| 合计 | 17,452.82 |
| 完成度 | 53.74% |
3)2022年及以后年度增长率分析考虑到标的公司深耕消化内镜诊疗耗材市场多年,在国内品牌中具有一定的知名度和相对较高的市场份额,已在消化内镜器械市场发展中取得先发优势。本次收益法评估对2022年及以后年度的预测主要参考了行业整体的发展趋势。
鉴于近年人们健康需求日益增加,加之人口老龄化的加深,医疗卫生事业不断发展,作为医疗服务中重要组成部分的医疗器械市场也得到了长足的发展。在消化内镜诊疗器械市场,根据智研咨询数据显示,2015-2019年国内内镜诊疗器械市场规模复合增长率为14.44%,处于快速扩张阶段。受新冠疫情带来的医院诊疗量下降的影响,2020年市场规模有所下降,但未来几年我国内镜诊疗器械市场有望保持10%-20%复合增长率,以2019年我国内镜诊疗器械市场规模
42.2亿元为基数进行测算,预计至2024年,我国内镜诊疗器械市场规模有望达到70亿元以上。
相比行业竞争对手而言,标的公司在产品质量和技术水平、销售渠道、运营管理等方面均具有一定优势,经过多年发展标的公司已经建立了一支高素质、专家型管理团队,并对行业整体发展趋势形成了独到的见解和历史积淀。标的公司作为国内少数产品全方面覆盖消化内镜器械的企业,在市场竞争中拥有较强的先发优势。同时考虑到医疗器械行业具有较高的技术壁垒和准入壁垒,潜在竞争者较难进入该领域,也使得在市场整体快速发展过程中占据头部位置的企业可以更为容易地获取市场份额。在综合考虑行业发展规律和公司竞争优势的基础上,本次预计标的公司基础诊断类产品销售量增速高于行业平均增速,同时2022年及以后年度的预测增长率在2021年增长率的基础上保持持续下降的趋势,较为谨慎地估计了企业在未来经营过程中所面临的市场竞争和行业变
2-2-226
化风险。综上所述,标的公司基础诊断类产品2021年销售情况良好,2021年1-6月已实现销售数量符合预期且已超过全年预测销量的50%。此外,内镜诊疗器械行业市场整体发展趋势良好,未来市场空间容量也将有利于企业产品保持持续增长,本次收益法评估对基础诊断类产品销售量的预测具备合理性。
其他产品大类参照基础诊断类产品的预测方式进行预测。
3、本次收益法评估中对标的资产产品销售量、销售价格的评估预测合理性分析从目前开展集中带量采购的产品种类来看,主要为冠脉球囊、人工晶体、骨科关节、心脏起搏器、吻合器等心血管介入、骨科、眼科三大领域的高值耗材。相比人工关节、人工晶体和冠状动脉支架等产品在进入带量采购前的市场售价均超过万元,进入集中带量采购后虽然降幅明显但降价后价格仍显著高于被评估单位目前涉及的内窥镜耗材产品。标的公司产品平均销售单价相对较低,尽管临床需求量较大,但临床采购金额较低,短期内进入全国性带量采购范围内的可能性较小。
同时,带量采购调整的价格为终端价格并非被评估单位的出厂价格。报告期内,被评估单位以经销模式为主要销售模式,其出厂价格与终端价格之间已经预留了较为合理的利润空间,因此未来如受带量采购政策影响导致终端价格的下降,终端价格反向传导至被评估单位出厂价格的降幅有限,对被评估单位的预测单价的降幅影响有限。
医疗器械带量采购政策对于医疗器械企业而言是风险与机遇并存。从目前的带量采购实施情况来看,纳入带量采购清单的中标产品销售单价将有一定程度的下降,但也同时带来销量的显著增加。对于生产制造企业而言,执行集中带量采购一方面有助于提高企业的公平竞争环境、有助于优质产品快速推广,另一方面也可以降低企业的销售费用和相关成本,有利于实现以量换价。
本次收益法评估中主要考虑到一方面市场对低值医疗耗材实行集中带量采购的相关政策时间目前还未有统一和明确安排,另一方面目前市场中亦无同类型产品的集中带量采购先例进行参考,且标的公司目前尚未有产品执行带量采
2-2-227
购,故在销量预测中无法量化中标概率。如未来标的公司部分产品纳入“带量采购”目录,基于标的公司的行业竞争地位及产品优势,预计标的公司具备入围中标的竞争优势。此外,报告期内,标的公司境外销售收入约占整体销售收入的40%。考虑到标的公司与境外主要客户均建立了长期良好的合作关系且报告期内经销销售单价均保持了较为稳定的趋势。标的公司丰富的销售区域将有效降低未来国内相关政策执行时间和执行范围不确定的影响。
4、同行业可比公司对未来行业政策、公司经营风险的预判情况根据公开市场披露信息,同行业可比公司对于未来行业政策、公司经营风险的披露信息情况如下:
(1)医疗器械“两票制”的推行对行业内公司业绩的影响
根据南微医学(688029.SH)招股说明书披露信息:
截至2018年底,全国只有陕西、山西、安徽、福建等少数省份在医疗器械领域实现“两票制”试点。在“两票制”的环境下,发行人产品的推广方式将从以经销商推广方式为主,转变为以发行人、配送商和第三方服务机构推广相结合的方式。在新的推广方式下,发行人产品价格和销售费用将有所上升,净利润所受影响较小。
(2)内窥镜耗材集中带量采购的推行对行业内公司业绩的影响
根据公开市场信息中披露的南微医学(688029.SH)2020年机构调研与投资者问答中,南微医学表示:1)在内镜诊疗行业,目前还是进口品牌占多数市场份额,而集中带量采购给我们国内企业带来的是进口替代的机会,是有利于国产医疗器械发展的一项政策。2)医保带量采购主要压缩的是渠道商的利润空间。新政策有利于规模大品种多的大中型企业。
由上可见,标的公司对于未来行业政策及经营风险的判断与同行业可比公司基本一致。
5、全球市场的增长趋势与本次收益法预测的匹配性
(1)全球及中国医疗器械市场规模及预期
2-2-228
根据《中国医疗器械蓝皮书(2021 版)》,2016年至2020年全球医疗器械行业5年复合增长率为6.25%。
2016年-2020年全球医疗器械行业市场规模
数据来源:《中国医疗器械蓝皮书(2021版)》
此外,据Evaluate MedTech预计,到2024年,全球医疗器械销售规模将会达到5,494亿美元,年复合增长率为5.60%。
从全球市场角度分析,全球医疗器械市场在近年增速不及国内市场,主要原因系全球医疗器械行业的市场集中度较高,世界医疗器械的生产国主要集中于美国、欧盟、日本和中国,而消费市场亦主要集中于上述地区。而上述区域中除中国以外大部分为欧美发达地区。其医疗器械市场相对说来也较为成熟,医院装备水平较高,因此其市场基数较大而增量部分较小。与此同时,部分欠发达地区和“一带一路”范围内的国家对医疗器械具有极大的潜在需求,但其市场尚不成熟,仍亟需开拓。
2020年底,“一带一路”医学器械创新与应用联盟在上海成立,旨在共建共享医疗器械命运共同体,引领打造具有生命力的医疗器械产学研创新应用生态体系。成员由最初参与倡议的19个增加到55个,除中国、美国和其他欧盟国家以外,还包括吉尔吉斯斯坦、巴基斯坦、塞尔维亚、斯洛文尼亚、罗马尼亚等经济发展相对滞后的国家。未来随着中国企业在国际领域与世界范围内的客户及合作伙伴关系进一步加深,非洲、拉美、中亚等地区将成为全球医疗器
2-2-229
械市场中新的“蓝海”。
根据弗若斯特沙利文分析,2019年,中国医疗器械市场规模为6,235亿人民币,其中医疗设备市场规模为2,336亿人民币,医用耗材市场规模为3,899亿人民币。预计到2024年,中国医疗器械市场整体规模将达到12,295亿人民币,其中医疗设备市场规模将达到4,458亿人民币,医用耗材规模将达到7,838亿人民币。复合年增长率为14.5%,其中医用耗材符合年增长率为15.0%。
中国医疗器械市场规模按设备和耗材拆分,2015-2024E
| 单位:十亿人民币期间复合年增长率医疗设备医用耗材总计2015-201917.5%20.4%19.3%2019-2024E13.8%15.0%14.5% | ||||
| 122.7 144.9 171.7 200.7 233.6 271.3 313.3 351.8 398.0 445.8 185.3 225.1 268.6 327.7 389.9 458.1 531.4 611.2 699.8 783.8 308.0 370.0 440.3 528.4 623.5 729.5 844.7 963.0 1,097.8 1,229.5 201520162017201820192020E2021E2022E2023E2024E | ||||
| 医疗设备 | 医用耗材 | |||
数据来源:弗若斯特沙利文
标的公司报告期内境内销售业务收入的占比约为60%,境内收入是标的公司业绩实现的重要组成部分。在境内医疗器械市场持续高速发展的前提下,标的公司也将获得因国内市场整体发展而带来的机遇。
(2)全球及国内内镜诊疗器械市场发展前景分析
根据波士顿科学的统计和预测数据,2018年全球内镜诊疗器械市场规模约为52.2亿美元,2021年预计会达到60.8亿美元,2018-2021年复合增长率为5%。2018年全球应用于胆胰管疾病、消化道癌症和消化道出血领域的器械市场规模分别为14亿美元、14亿美元及6亿美元,预计到2021年将分别达到17亿美元、18亿美元及6.75亿美元,复合增长率分别为6.7%、8.7%、4.0%,全球消化内镜诊疗器械市场空间仍有较大的增长潜力。
根据Evaluate MedTech的数据显示,2017年全球内镜诊疗器械(设备+耗材)的市场规模为185亿美元,2024年其市场规模有望达到283亿美元,复合
2-2-230
增长率为6.3%,高于同期全球医疗器械市场规模增速。国内内镜诊疗器械市场起步晚,但增速远超全球,行业景气度高。根据智研咨询数据显示,2015-2019年国内内镜诊疗器械市场规模复合增长率为
14.44%,处于快速扩张阶段。受新冠疫情带来的医院诊疗量下降的影响,2020年市场规模有所下降。未来几年我国内镜诊疗器械市场有望保持10%-20%复合增长率,以2019年我国内镜诊疗器械市场规模42.2亿元为基数进行测算,预计至2024年,我国内镜诊疗器械市场规模有望达到70亿元以上。
本次收益法评估详细预测期5年营业收入复合增长率与历史年度复合增长率及市场预期未来复合增长率的对比如下:
| 区域\指标 | 复合增长率 | 数据来源 |
| 全球医疗器械市场(2016年-2020年) | 6.25% | 中国医疗器械蓝皮书(2021 版) |
| 预期全球医疗器械市场(至2024年) | 5.60% | Evaluate MedTech |
| 中国医疗器械市场(2015年-2019年) | 17.50% | 弗若斯特沙利文 |
| 预期国内医疗器械市场(2019年-2024年) | 14.50% | 弗若斯特沙利文 |
| 预期国内医用耗材市场(2019年-2024年) | 15.00% | 弗若斯特沙利文 |
| 全球内镜诊疗器械市场规模(2018年-2021年) | 4.0%-8.7% | 波士顿科学 |
| 预期全球内镜诊疗器械市场规模(至2024年) | 6.3% | Evaluate MedTech |
| 国内内镜诊疗器械市场(2015年-2019年) | 14.44% | 智研咨询 |
| 预期国内内镜诊疗器械市场(至2024年) | 10%-20% | 中国产业调研网、智研咨询、光大证券、国元证券等 |
| 本次标的公司预测营业收入 | 18.05% |
标的公司深耕消化内镜医疗器械领域,顺应行业发展趋势,报告期内取得了较好的发展,预期未来能继续保持较高的营业收入增长态势,具体原因如下:
1)境外销售方面
从行业发展增速来看,预期至2024年,全球医疗器械市场复合增速为5.60%,其中内镜诊疗器械市场复合增速略高于全球医疗器械增速,为6.30%。
标的公司从事消化内镜诊疗医疗器械加工出口业务已逾十年,建立了严格的质量管控体系,多项核心产品均已取得欧盟CE、ISO13485、韩国KGMP、MDSAP等国内外权威认证。
2-2-231
经过多年的合作和培育,标的公司积累了一批优质的境外ODM客户,其中不乏PENTAX EUROPE GMBH及 FUJIFILM MEDWORK GMBH等知名内窥镜诊疗领域客户。标的公司通过稳定的供应链水平及优质的产品质量确保了境外客户与标的公司之间深厚的合作关系,报告期内,标的公司境外收入规模持续上升,其中2021年1-6月境外收入较2020年同期增速达44.74%,远高于全球内镜诊疗器械规模行业增速。
随着全球内镜诊疗器械市场的持续发展,标的公司下游客户的采购需求稳定增加,预计标的公司境外收入规模增速将持续保持较高水平发展。
2)境内销售方面
从行业发展增速来看,根据弗若斯特沙利文的分析,预期国内医用耗材市场规模将保持15.00%的复合增长率,消化内镜诊疗器械作为增长较快的医疗器械子行业之一,其增速预计将高于同期医疗器械市场规模增速。
标的公司深耕消化内镜诊疗耗材市场多年,在国内品牌中具有一定的知名度和相对较高的市场份额,已在消化内镜器械市场发展中取得先发优势。相比行业竞争对手而言,标的公司在产品质量和技术水平、销售渠道、企业管理等方面均具有一定优势。同时考虑到医疗器械行业具有较高的技术壁垒和准入壁垒,潜在竞争者较难进入该领域,也使得在市场整体快速发展过程中占据头部位置的企业可以更为容易地获取市场份额。
在综合考虑行业发展前景和市场整体容量、销售区域配置、标的公司竞争优势及行业地位等因素的基础上,本次预测标的公司未来5年营业收入复合增长率18.05%,符合全球市场的增长趋势,具备合理性。
五、本次评估预测对疫情因素的考量
(一)疫情影响情况下,标的资产2020年实现收入、销量较高增长的合理性
1、标的公司境内收入增长情况
报告期内,标的公司境内收入增长情况如下:
2-2-232
单位:万元
| 地区分类 | 2021年 1-6月 | 占比 | 2020年度 | 占比 | 2020年1-6月 | 占比 | 2019年度 | 占比 |
| 境内收入合计 | 12,691.45 | 58.17% | 23,349.94 | 62.45% | 9,689.96 | 41.50% | 15,674.02 | 58.08% |
| 境内收入(扣除口罩业务) | 12,687.70 | 58.16% | 19,143.21 | 51.20% | 8,276.47 | 43.23% | 15,674.02 | 58.08% |
| 地区分类 | 2021年1-6月同期增长率 | 2020年增长率 | ||||||
| 境内收入合计 | 30.98% | 48.97% | ||||||
| 境内收入(扣除口罩业务) | 53.30% | 22.13% | ||||||
报告期内,标的公司境内收入(扣除口罩业务)分别为15,674.02万元、19,143.21万元及12,687.70万元,2020年较2019年收入增速为22.13%。标的公司2020年境内收入增长的主要原因如下:
(1)2020年上半年较2019年同期收入增速为14.24%,2020年下半年较2019年同期收入增速为26.71%。2020年上半年受到疫情影响,标的公司销售情况有所放缓,2020年下半年随着境内疫情逐步得到控制,销售收入逐步上升。此外,随着国内疫情防控趋势持续向好,标的公司2021年1-6月境内收入增速明显,较2020年同期增速达53.30%。
(2)标的公司进一步加大市场推广力度,覆盖的终端医院数量逐步上升,其中2020年覆盖终端医院数量2,203家较2019年增加344家,此外终端医疗机构的结构也得到了一定的优化,公立医院由2019年1,695家增加至2020年2,082家, 销售收入相应增长。
(3)标的公司于2019年起陆续开始对销售团队组织架构进行优化调整,报告期内,标的公司境内销售人员数量分别为46人、61人及67人。对于销售业绩未能达标的销售人员进行优胜劣汰的同时在各地区引入了诸多具备较强营销能力的销售人员,并进一步提升的销售团队的激励措施,这一举措在2020年初见成效。
(4)标的公司在消化内镜耗材领域已经具有较为完整的全产品线覆盖,通过优势产品的销售可以进一步带动其他品类产品的协同销售,其ERCP及ESD类产品在2020年实现了较好的协同销售效应,与同期南微医学相同品类产品增速亦保持了一致,具体如下:
2-2-233
单位:万元
| 产品类别 | 2020年度 | 占比 | 2020年同比增速 | 2019年度 | 占比 | |
| 标的公司 | 南微医学 | |||||
| 基础诊断类 | 7,837.63 | 33.57% | 3.51% | -23.48% | 7,571.76 | 48.31% |
| 止血闭合类 | 1,514.17 | 6.48% | 118.35% | 0.19% | 693.47 | 4.42% |
| ERCP类 | 5,005.25 | 21.44% | 27.36% | 31.57% | 3,929.98 | 25.07% |
| ESD类 | 2,124.10 | 9.10% | 74.37% | 30.03% | 1,218.17 | 7.77% |
| 泌尿骨科类医疗器械 | 1,637.66 | 7.01% | 4.78% | / | 1,562.53 | 9.97% |
| 医用配件 | 64.44 | 0.28% | 8.76% | / | 59.25 | 0.38% |
| 金属支架类医疗器械(贸易) | 959.97 | 4.11% | 50.26% | / | 638.87 | 4.08% |
注:南微医学未区分境内外披露分产品类别增速,此处以其合并口径披露,因境外受疫情影响,预计其境内增速高于整体增速;南微医学未披露基础诊断类,此处以其活检类替代
2、标的公司境外收入增长情况
报告期内,标的公司境外收入增长情况如下:
单位:万元
| 地区分类 | 2021年 1-6月 | 占比(%) | 2020年度 | 占比(%) | 2020年1-6月 | 占比(%) | 2019年度 | 占比(%) |
| 境外收入合计 | 9,125.30 | 41.83 | 14,040.53 | 37.55 | 8,186.45 | 45.79 | 11,312.89 | 41.92 |
| 境外收入(扣除口罩业务) | 9,125.30 | 41.83 | 12,156.67 | 32.51 | 6,304.40 | 43.24 | 11,312.89 | 41.92 |
| 地区分类 | 2021年1-6月同期增长率 | 2020年增长率 | ||||||
| 境外收入合计 | 11.47% | 24.11% | ||||||
| 境外收入(扣除口罩业务) | 44.74% | 7.46% | ||||||
标的公司2020年上半年境外收入较2019年同期增速为15.36%,2020年下半年境外收入较2019年同期增速仅为0.08%,2020年全年境外收入较2019年小幅增长。其原因主要系受到疫情影响,特别是2020年下半年,境外疫情形势较为严峻所致。随着境外疫苗接种率的提升,防疫效果取得阶段性成果,境外逐步复工复产,标的公司于2021年1-6月境外收入较2020年同期增速达44.74%,取得较为明显的增长。关于境外收入的销售实现参见本节之“(三)”的相关回复。
(二)标的公司报告期收入增长率与同行业上市公司的可比性
报告期内,标的公司收入增长率与可比上市公司的对比情况如下:
2-2-234
| 证券代码 | 证券简称 | 2021年1-6月收入增长率 | 2020年收入增长率 |
| 603309.SH | 维力医疗 | -13.81% | 13.77% |
| 688029.SH | 南微医学 | 53.34% | 1.45% |
| 688677.SH | 海泰新光 | 0.30% | 8.83% |
| 300003.SZ | 乐普医疗 | 53.87% | 3.12% |
| 300529.SZ | 健帆生物 | 36.63% | 36.24% |
| 可比公司平均值 | 26.06% | 12.68% | |
| 可比公司中位数 | 36.63% | 8.83% | |
| 唯德康医疗 | 22.04% | 38.52% | |
| 唯德康医疗(剔除口罩收入) | 49.06% | 15.97% | |
注:标的公司同行业可比公司南微医学海外销售的国家和地区主要包括美国、欧洲、加拿大、澳大利亚等国家和地区,其中在美国、德国主要分别依托子公司MTU、MTE直销
标的公司2020年剔除口罩业务后的营业收入增长率略高于同行业可比上市公司平均值,但总体较为匹配。2021年以来,标的公司业务进一步回暖,销售收入同比增速达49.06%,高于可比公司平均水平,与南微医学基本一致。
(三)评估预测中对疫情影响境外收入的考虑及谨慎性
1、境外政治经济环境、外汇管理、贸易政策等对标的资产销售的影响及应对措施
报告期内,标的公司对外出口产品主要销往德国、法国、意大利、比利时等欧洲国家,以及韩国、日本、越南、澳大利亚等亚太地区国家。
经查阅标的公司主要出口国相关信息,在政治经济环境方面,标的公司主要出口国最近三年政治经济形势均未发生重大变化。
外汇管理政策方面,报告期内,标的公司与境外客户的合作是货物贸易业务,不存在资本金融、个人外汇等其他外汇业务,因此,出口国外汇管理政策对标的公司经营影响相对较小。
在贸易政策方面,欧洲及亚太地区与我国的贸易政策相对较为平稳,目前暂时没有针对标的公司产品的关税等歧视性政策。从美国地区来看,标的公司产品目前暂不在中美贸易战加征关税商品清单中。同时,标的公司报告期内向美国实现的销售金额合计为10.96万元,金额较小。中美贸易战对标的公司未来销售影响较小。
2-2-235
总体而言,标的公司主要出口国家和地区经济较发达,市场比较成熟,政治、经济和法律环境总体稳定,外汇管理政策、贸易政策等比较透明。目前标的公司主要出口国均与中国保持了良好的经贸合作关系,不存在较大的贸易争端,不会对标的公司境外销售产生重大影响。
2、2020年及2021年上半年,境外收入及回款情况
标的公司2020年及2021年上半年境外收入情况如下:
| 项目 | 2021年1-6月 | 2020年 | 2020年7-12月 | 2020年1-6月 | 2019年 | 2019年7-12月 | 2019年1-6月 |
| 境外销售收入(剔除口罩收入)(万元) | 9,125.30 | 12,156.67 | 5,852.27 | 6,304.40 | 11,312.89 | 5,847.83 | 5,465.06 |
| 同比增长率 | 44.74% | 7.46% | 0.08% | 15.36% | / | / | / |
| 境外口罩收入(万元) | - | 1,883.87 | 1.81 | 1,882.05 | - | - | - |
| 境外销售收入占主营业务收入的比例 | 41.83% | 38.84% | 35.00% | 43.24% | 41.92% | 40.54% | 43.50% |
2020年及2021年上半年,境外收入(剔除口罩收入)分别为12,156.67万元及9,125.30万元,其中2020年标的公司境外收入(剔除口罩收入)较2019年同期收入增速为7.46%,增速放缓主要原因系受到境外疫情的影响,特别是2020年下半年,境外疫情形势较为严峻,标的公司2020年下半年境外收入较2019年同期增速仅为0.08%。随着境外疫苗接种率的提升,防疫效果取得阶段性成果,境外逐步复工复产,标的公司于2021年1-6月境外收入较2020年同期增速达
44.74%,取得较为明显的增长。
此外,由于标的公司境外销售模式以贴牌模式为主,考虑到国内复工复产形势较好,境外厂商基于对生产供应链的稳定性要求,亦加大对境内医疗器械生产厂商的采购需求,进一步助推了境外销售收入的实现。
报告期内,标的公司应收账款周转率具体情况如下:
| 项目 | 2021年1-6月 | 2020年度 | 2019年度 |
| 整体应收账款周转率(剔除口罩收入) | 9.07 | 9.66 | 11.98 |
| 境外应收账款周转率(剔除口罩收入) | 7.89 | 10.63 | 15.55 |
注:2021年1-6月应收账款周转率进行了年化处理
2-2-236
报告期内,标的公司境外应收账款周转率有所下降,主要原因系标的公司针对境外客户信用政策一般根据运输方式和运输时间确定,如收到发票后、收到提单后、发货后或收货后一定期限内(7天、30天、60天等)结清货款。受疫情影响,境外运输物流时间延长,导致标的公司应收账款周转率有所下降。报告期内,标的公司境外应收账款回款良好,各期期末应收账款均已收到回款。
3、评估预测中对疫情影响境外收入的考虑及谨慎性情况分析
报告期内,标的公司境外收入方面呈现如下特点:
(1)从销售区域来看,标的公司对外出口产品主要销往德国、法国、意大利、比利时等欧洲国家,以及韩国、日本等亚太地区国家。该等国家政治经济环境较为稳定,社会保障福利较高。
(2)从销售模式来看,标的公司境外销售模式以贴牌模式为主,境外业务主要取决于标的公司产品质量的稳定性和生产供应的及时性,标的公司自行承担的境外市场推广风险较小。报告期内,得益于标的公司持续高质量的生产供应链,境外客户的采购订单较为稳定。
(3)从境外客户来看,报告期内,标的公司已经与境外主要客户形成了长期稳定的合作关系,并凭借自身优质的产品供应不断增加存量客户的采购订单。
基于上述境外销售的特点,标的公司境外销售在2020年受到一定疫情影响后,较快地实现销售回暖,并取得一定程度的销售增速。具体情况如下:
(1)标的公司产品主要销往欧洲及亚太发达国家
标的公司境外销售收入(剔除口罩业务)分布情况如下:
单位:万元
| 国家 | 2021年1-6月 | 占比 | 2020年 | 占比 | 2019年 | 占比 | 增长率 |
| 德国 | 4,203.59 | 46.07% | 4,708.17 | 38.73% | 4,015.00 | 35.49% | 17.26% |
| 法国 | 2,322.48 | 25.45% | 3,257.23 | 26.79% | 3,250.52 | 28.73% | 0.21% |
| 韩国 | 758.06 | 8.31% | 1,472.95 | 12.12% | 1,093.40 | 9.67% | 34.71% |
| 日本 | 109.20 | 1.20% | 203.71 | 1.68% | 20.95 | 0.19% | 872.36% |
| 意大利 | 298.83 | 3.27% | 557.27 | 4.58% | 562.01 | 4.97% | -0.84% |
2-2-237
| 国家 | 2021年1-6月 | 占比 | 2020年 | 占比 | 2019年 | 占比 | 增长率 |
| 比利时 | 234.01 | 2.56% | 296.21 | 2.44% | 445.35 | 3.94% | -33.49% |
| 其他国家 | 1,199.13 | 13.14% | 1,661.12 | 13.66% | 1,925.66 | 17.01% | -13.74% |
| 总计 | 9,125.30 | 100.00% | 12,156.67 | 100.00% | 11,312.89 | 100.00% | 7.46% |
2019年及2020年,标的公司境外收入集中在德国、法国及韩国,前述三个国家合计贡献收入占境外收入比例为73.89%及77.64%。根据中国医药保健品进出口商会统计,2019 年我国医疗器械出口规模达到 287.02 亿美元,增速达到
21.5%,2020年我国医疗器械出口规模达到1,015亿美元,增速高达253.63%。从出口市场看,出口地主要为美国、英国、德国、日本和法国等,其中出口法国、英国的增幅显著,分别为755.5%和659.7%
。标的公司境外收入主要来源于德国、法国等地,2020年受益于全球供应链产能的转移,标的公司仍取得较好的增速。
此外,2021年以来,随着境外疫防控逐步趋于稳定,标的公司境外收入已经实现较快增长,2021年1-6月境外销售收入合计为9,125.30万元,同比增速达到44.74%,占2020年境外收入金额比例为75.06%。
(2)标的公司与主要境外客户具有稳定合作关系
标的公司境外销售模式以贴牌模式为主,报告期各期,标的公司境外贴牌模式前五大客户情况如下:
单位:万元
| 期间 | 序号 | 客户名称 | 销售内容 | 金额 | 占境外收入的比例 |
| 2021年1-6月 | 1 | PENTAX EUROPE GMBH | 基础诊断类、ERCP类、ESD类、止血闭合类 | 2,755.12 | 30.19% |
| 2 | LIFE PARTNERS EUROPE及其关联公司 | 基础诊断类、ESD类、止血闭合类 | 2,322.48 | 25.45% | |
| 3 | FUJIFILM MEDWORK GMBH | 基础诊断类、ERCP类、止血闭合类 | 901.74 | 9.88% | |
| 4 | MTW-ENDOSKOPIE W. HAAG KG | 基础诊断类、ERCP类、ESD类 | 546.73 | 5.99% | |
| 5 | MEDITALIA | 基础诊断类、ERCP类、ESD类、止血闭合类 | 294.19 | 3.22% | |
| 小计 | 6,820.27 | 74.74% | |||
| 2020 | 1 | LIFE PARTNERS | 基础诊断类、ERCP类、 | 4,853.03 | 34.56% |
数据来源:中国医药保健品进出口商会、众成医械
2-2-238
| 期间 | 序号 | 客户名称 | 销售内容 | 金额 | 占境外收入的比例 |
| 年度 | EUROPE及其关联公司 | ESD类、止血闭合类、口罩 | |||
| 2 | MTW-ENDOSKOPIE W. HAAG KG | 基础诊断类、ERCP类、ESD类、止血闭合类 | 2,348.61 | 16.73% | |
| 3 | FUJIFILM MEDWORK GMBH | 基础诊断类、ERCP类、止血闭合类、口罩 | 1,797.28 | 12.80% | |
| 4 | MEDITALIA | 基础诊断类、ERCP类、ESD类 | 550.81 | 3.92% | |
| 5 | PENTAX EUROPE GMBH | 基础诊断类、ESD类、止血闭合类 | 474.40 | 3.38% | |
| 小计 | 10,024.13 | 71.39% | |||
| 2019年度 | 1 | LIFE PARTNERS EUROPE及其关联公司 | 基础诊断类、ERCP类、ESD类、止血闭合类 | 3,250.52 | 28.73% |
| 2 | FUJIFILM MEDWORK GMBH | 基础诊断类、ERCP类、ESD类、止血闭合类 | 2,013.11 | 17.79% | |
| 3 | MTW-ENDOSKOPIE W. HAAG KG | 基础诊断类、ERCP类、ESD类、止血闭合类 | 1,921.56 | 16.99% | |
| 4 | MEDITALIA | 基础诊断类、ERCP类、ESD类 | 559.26 | 4.94% | |
| 5 | G-FLEX EUROPE SPRL | 基础诊断类、ERCP类、ESD类、止血闭合类 | 445.14 | 3.93% | |
| 小计 | 8,189.59 | 72.38% | |||
标的公司境外销售以贴牌模式为主,对于贴牌销售客户,标的资产与主要贴牌客户建立了良好的合作关系,并且贴牌销售客户通常会与供应商建立长期稳定的合作关系以保证其产品的性能与质量稳定性,具有较强的业务粘性,一般不会轻易更换主要的合作厂商。标的公司核心贴牌客户均在内镜诊疗领域具有多年的耕耘,其中PENTAXEUROPE GMBH系提供内窥镜影像解决方案,在日本,欧洲和美国均设有研发创新和生产制造中心;FUJIFILM MEDWORK GMBH(富士胶片)已成为世界上规模最大的综合性影像、信息、文件处理类产品及服务的制造和供应商之一。 作为在医疗诊断及医用信息领域中处于领先地位的企业,富士胶片致力于创造精准的医学图像,并提供综合内窥镜解决方案。该等客户均具备较强的品牌影响力和知名度,在疫情期间亦保持了强劲的供应链需求,与标的公司在报告期内保持了深厚的合作关系。标的公司历史年度主要客户结构较为稳定,2020年以来,国内复工复产形势较好,境外厂商基于对生产供应链的稳定性要求,亦加大对境内医疗器械生产厂商的采购需求,进一步助推了境外销售收入的实现。
2-2-239
(3)标的公司与同行业可比上市公司在境外销售收入占比及应收账款周转率的对比情况标的公司与同行业可比上市公司的应收账款周转率比较情况如下:
| 证券代码 | 证券简称 | 2021年1-6月应收账款周转率 | 2020年应收账款周转率 |
| 688029.SH | 南微医学 | 3.58 | 7.07 |
| 300003.SZ | 乐普医疗 | 3.04 | 3.77 |
| 603309.SH | 维力医疗 | 5.41 | 11.14 |
| 688677.SH | 海泰新光 | 2.91 | 6.86 |
| 300529.SZ | 健帆生物 | 5.44 | 11.98 |
| 可比公司平均值 | 4.07 | 8.16 | |
| 可比公司中位数 | 3.58 | 7.07 | |
| 唯德康医疗 | 4.54 | 9.66 | |
标的公司与同行业上市公司的境外销售收入占比对比情况如下:
| 证券代码 | 证券简称 | 2020年境外销售收入占比 |
| 688029.SH | 南微医学 | 38.71% |
| 300003.SZ | 乐普医疗 | 44.04% |
| 603309.SH | 维力医疗 | 54.65% |
| 688677.SH | 海泰新光 | 86.31% |
| 300529.SZ | 健帆生物 | 2.75% |
| 可比公司平均值 | 45.29% | |
| 可比公司中位数 | 44.04% | |
| 唯德康医疗 | 37.55% | |
由上表可知,唯德康医疗在境外销售收入占比与同行业可比上市公司平均水平一致的同时,公司整体应收账款周转率显著高于同行业可比上市公司,显示出疫情对公司境外销售业务的回款及时性并未构成显著影响,且公司整体应收账款回款效率高于同行业可比上市公司。
(4)评估预测中对疫情影响境外收入的考虑及谨慎性分析
1)销售收入预测的合理性分析
2-2-240
考虑标的公司境外销售的特点,本次评估对销售收入并未单独区分境内外产品进行分开预测,按照产品类别进行总体预测,预测期营业收入整体增长情况如下:
| 序号 | 项目 \ 年份 | 2021 | 2022 | 2023 | 2024 | 2025 |
| 1 | 营业收入合计(万元) | 41,974.23 | 51,794.19 | 63,214.78 | 72,467.65 | 81,525.09 |
| 2 | 增长率 | 12.19% | 23.40% | 22.05% | 14.64% | 12.50% |
2)关于销售回款的预测
本次评估在分析公司销售政策、历史回款情况及报告期内公司应收账款周转率等因素下,考虑疫情对境外收入回款情况的影响,具体如下:
在本次收益法测算的营运资金增加额的计算中,各项流动资产及负债的周转率本次均采用了以2021年1-3月为基础计算得出的周转率数据。在此周转率计算下,应收账款、预付账款和存货周转率的对比情况如下:
| 项目\年度 | 2020年 | 2021年1-3月(本次评估选用值) | 2021年1-6月 |
| 应收账款周转率 | 11.50 | 8.70 | 9.07 |
| 预付款项周转率 | 31.60 | 30.90 | 28.46 |
| 存货周转率 | 3.50 | 3.20 | 4.09 |
注:2021年1-3月、2021年1-6月周转率计算参数中主营业务收入、主营业务成本已进行年化处理。
由上表可知,以2021年1-3月为基础计算得出的周转率数据低于2020年全年数据,以此计算可以更为谨慎地反映未来公司对于营运资金的需求水平。
与此同时,在报告期内,标的公司针对经销商主要为先款后货的模式进行结算,此外综合考虑经销商规模、信用、合作期限等因素,对信用期较好的经销商给予一定的信用期(多为1个月),与供应商的结算周期接近。
本次收益法评估过程中,对营运资金计算中的货币资金安全保有量按2个月的付现成本进行计算,提高了公司对最低资金保有量的需求,进而增加了预测期中对营运资金增加额的预测,充分考虑了可能存在的季节性波动和境外疫情对公司营运资金保有量的影响。
综上所述,标的公司在境外销售占比与同行业可比上市公司平均值一致的情况下,公司整体应收账款周转率显著高于同行业可比上市公司,显示出公司
2-2-241
回款状况良好,本次疫情对标的公司境外销售收入的回款情况并未构成实质性影响。与此同时,本次收益法预测在营运资金增加额的估算过程中,通过采用较低的周转率参数和较高的安全资金保障月数,充分估计了公司未来营运资金的需求量。
(四)预测期收入增长率的可实现性和谨慎性分析
本次评估结合国内国际宏观经济情况、境内外疫情防控情况、行业发展情况及公司自身情况等四个方面,对预测期收入增长率的可实现性和谨慎性进行了分析,具体如下:
1、国内宏观经济情况
2021年上半年,我国经济持续稳定恢复,发展基础更加巩固,工业生产稳定增长,企业经营状况继续改善。上半年,我国国内生产总值(GDP)为532,167.00亿元,按可比价格计算,同比增长12.7%,两年平均增长5.3%。1月份至6月份,规模以上工业增加值同比增长15.9%,增速较一季度回落8.6个百分点;两年平均增速为7.0%(以2019年相应同期数为基数,采用几何平均的方法计算),较一季度加快0.2个百分点,增速略高于疫情前水平。工业出口交货值快速增长。1月份至6月份,我国工业出口交货值实现同比增长22.9%,两年平均增速为
8.1%。1月份至5月份,规模以上工业企业利润同比增长83.4%。营业收入利润率有所提升,1月份至5月份为7.11%,同比提高2.05个百分点。企业亏损面持续缩小,亏损企业亏损额同比减少29.6%。
2、国际宏观经济情况
根据《中国社会科学院国际形势报告(2021)》,在经历新冠肺炎疫情冲击的经济下挫之后,2021年国际经济将在此前较低的基数基础上重启增长,根据国际货币基金组织(IMF)预计,2021年世界经济实际GDP增长率将达到5.5%,较上年增长回升9个百分点。同时,随着疫苗接种加快以及封锁措施解除,欧盟地区经济出现复苏迹象,韩国、新加坡、越南等亚洲经济体经济也得到显著改善。
3、境内外疫情防控情况
进入2021年,全球范围内的新冠肺炎疫苗接种速度显著提升。
2-2-242
据国家卫健委公布的数据显示,截至6月30日,国内累计报告接种新冠疫苗已达12.446亿剂次。目前,包括北京、天津、海南等省市的18岁及以上人群疫苗全程接种率已经超过80%。中国距离建立群体免疫的目标越来越近。截至2021年8月31日,欧盟委员会主席宣布,欧盟已实现为70%成年人口完成新冠疫苗接种的目标。在北美地区,据COVID Tracker Canada统计数据,截至2021年7月末,加拿大50.19%的人口已全面接种新冠疫苗,69.605%的人口已完成第一剂的接种;美国在2021年8月也已实现70%的成年人口至少注射一剂新冠肺炎疫苗。
考虑到全球范围内的疫苗接种率不断提升,国内及境外欧美发达国家接种率均已超过70%,预期未来疫情对全球范围内的生产生活影响将进一步降低。
4、行业发展情况
鉴于近年人们健康需求日益增加,加之人口老龄化的加深,医疗卫生事业不断发展,作为医疗服务中重要组成部分的医疗器械市场也得到了长足的发展。在消化内镜诊疗器械市场,根据波士顿科学的统计和预测数据,2018年全球内镜诊疗器械市场规模约为52.2亿美元,2021年预计会达到60.8亿美元,2018-2021年复合增长率为5%。国内内镜诊疗器械市场起步晚,但增速远超全球,行业景气度高。根据智研咨询数据显示,2015-2019年国内内镜诊疗器械市场规模复合增长率为14.44%,处于快速扩张阶段。受新冠疫情带来的医院诊疗量下降的影响,2020年市场规模有所下降。未来几年我国内镜诊疗器械市场有望保持10%-20%复合增长率,以2019年我国内镜诊疗器械市场规模42.2亿元为基数进行测算,预计至2024年,我国内镜诊疗器械市场规模有望达到70亿元以上。
5、公司自身情况
相比行业竞争对手而言,标的公司在产品质量和技术水平、销售渠道、企业管理等方面均具有一定优势,经过多年发展标的公司已经建立了一支高素质、专家型管理团队,并对行业整体发展趋势形成了独到的见解和历史积淀。标的公司作为国内少数产品全方面覆盖消化内镜器械的企业,在市场竞争中具有较强的先发优势。同时考虑到医疗器械行业具有较高的技术壁垒和准入壁垒,潜
2-2-243
在竞争者较难进入该领域,也使得在市场整体快速发展过程中占据头部位置的企业可以更为容易地获取市场份额。经过多年发展,标的公司在国内消化内镜诊疗器械领域拥有4%的市场份额,处在国内企业前列。因此,基于标的公司产品竞争优势、先发优势、行业壁垒等因素,标的公司作为行业头部企业其发展速度预期将高于行业平均增速。
综上所述,在后疫情时代全球医疗机构控制医疗费用的需求更加强烈,医疗终端将更加倾向于选择高性价比医疗器械产品,因而,性价比更好、创新更快的中国品牌在全球市场有着巨大的市场空间。标的公司将抓住中国市场、发达国家市场和新兴市场的需求,不断提升在全球主要市场的品牌影响力和市场占有率。同时,根据标的公司2021年上半年财务数据,其业绩实现情况较好,2021年盈利预测具备较高的可实现性。
6、标的资产2021年盈利预测的可实现性
(1)2021年上半年标的公司主要财务数据
2021年1-6月标的公司主要财务数据情况如下:
| 指标 | 2021年1-6月 | 2021年全年预测数 | 占比/差异 |
| 营业收入(万元) | 21,826.15 | 41,974.23 | 52.00% |
| 营业成本(万元) | 9,001.85 | 16,900.37 | 53.26% |
| 毛利率 | 58.76% | 59.74% | -0.98% |
| 归属于母公司净利润(剔除股份支付) | 5,767.63 | 9,997.77 | 57.69% |
(2)在手订单情况
境内销售方面,标的公司主要以经销模式为主。针对授权区域主要经销商,标的公司通过与其签订年度框架协议设定年度销售目标,并分解至季度销售目标实现经销商管理。签约经销商通常根据授权地区的销售情况进行订单采购,历史期间经销商对于销售目标的完成度较高。针对其他经销商,标的公司与其维持了稳定的合作关系,该等经销商通常通过订单采购的形式,以相对稳定的频率对标的公司进行连续采购。
截至2021年6月30日,标的公司已与境内授权地区主要经销商完成框架协议的签署,按框架协议约定的目标销售金额统计,上述已签订框架协议的2021
2-2-244
年目标销售金额合计为24,267.55万元,截至2021年6月30日,在前述框架协议下的销售目标已完成11,538.53万元,剩余未实现目标销售额为12,729.02万元。具体如下表:
1)境内签署框架协议情况
| 项目 | 金额/比例 |
| 截至2021年6月30日,国内已有框架协议目标销售额合计(万元) | 24,267.55 |
| 截至2021年6月30日国内目标销售协议已实现销售收入(万元) | 11,538.53 |
| 已实现销售收入/已有框架协议目标销售额(%) | 47.55 |
2)预测收入覆盖情况
| 项目 | 金额/比例 |
| 截至6月30日,公司已确认销售收入(万元) | 21,826.15 |
| 截至6月30日,境内剩余未实现目标销售额(万元) | 12,729.02 |
| 截至6月30日,境外在手销售订单金额(万元) | 837.18 |
| 合计 | 35,392.35 |
| 2021年全年预测营业收入(万元) | 41,974.23 |
| 覆盖情况占比(%) | 84.32 |
与此同时,标的公司2021年1-6月与2020年度及2019年度同期销售情况对比如下:
| 项目 | 2019年1-6月 | 2020年1-6月 | 2021年1-6月 |
| 上半年销售收入(万元) | 12,563.07 | 17,876.41 | 21,826.15 |
| 全年销售收入(万元)(2021年为预测数) | 26,986.91 | 37,390.48 | 41,951.23 |
| 占比 | 46.55% | 47.81% | 52.03% |
由上表可知,2019年度及2020年度,标的公司上半年销售收入略低于下半年实现的销售收入,主要原因系上半年节假日较多所致。截至2021年6月30日,标的公司已实现销售收入21,826.15万元,相较于2021年度销售收入预测金额41,974.23万元,覆盖率达52.03%,与2019年度及2020年度同期销售覆盖率相比,完成度较高。
按2019年、2020年上下半年平均占比计算,2021年1-6月实际已完成销售收入对当期收益法预测收入的完成度约为110.21%。具体如下:
2-2-245
| 项目 | 比例/金额(万元) |
| 2019、2020年上半年销售金额占全年比重平均值 | 47.18% |
| 本次收益法预测销售收入推算2021年1-6月销售额 | 19,803.44 |
| 2021年1-6月已实现销售收入 | 21,826.15 |
| 完成度 | 110.21% |
2-2-246
第六节 发行股份情况
一、发行股份的种类和面值
股票种类:境内上市人民币普通股(A股)。每股面值:人民币1.00元。
二、发行对象及发行方式
本次拟发行股份购买资产的发行方式为向特定对象发行,发行对象为庄小金、缪东林、倍瑞诗和伊斯源。
三、发行价格及定价原则
根据《重组管理办法》的相关规定,上市公司发行股份的价格不得低于市场参考价的90%。市场参考价为本次交易的董事会决议公告日前20个交易日、60个交易日或者120个交易日的公司股票交易均价之一。
本次发行股份购买资产涉及的定价基准日为上市公司本次发行股份及支付现金购买资产的首次董事会决议公告日,即2021年4月26日。经计算,上市公司本次发行股份购买资产可选择的市场参考价为:
| 董事会决议公告日 | 前20个交易日 | 前60个交易日 | 前120个交易日 |
| 市场参考价(元/股) | 14.59 | 14.02 | 14.51 |
| 市场参考价的90%(元/股) | 13.13 | 12.62 | 13.06 |
交易均价的计算公式为:董事会决议公告日前若干个交易日公司股票交易均价=决议公告日前若干个交易日公司股票交易总额/决议公告日前若干个交易日公司股票交易总量。
经交易各方协商一致,本次发行股份购买资产的股份发行价格为于定价基准日前20个交易日公司股票交易均价,为14.59元/股。因上市公司实施2020年年度权益分派方案事项,本次股份发行价格调整为14.39元/股,本次发行价格已经上市公司2021年第一次临时股东大会审议确定。
在定价基准日至发行日期间,如上市公司出现派息、送股、资本公积金转增股本等除权除息事项,上市公司将按照深交所相关规则对本次发行价格和发行数
2-2-247
量作相应调整,最终发行股数以中国证监会最终核准的股数为准。发行价格的具体调整方法如下:
假设调整前发行价格为P0,每股送股或转增股本数为N,每股配股数为K,配股价为A,每股派息为D,调整后发行价格为P1(调整值保留小数点后两位,最后一位实行四舍五入),则:
派息:P1=P0-D
送股或转增股本:P1=P0/(1+N)
配股:P1=(P0+AK)/(1+K)
假设以上三项同时进行:P1=(P0-D+AK)/(1+K+N)
四、发行数量
按照以发行股份方式购买的标的公司的30%股权的交易对价41,700.00万元以及14.39元/股的发行价格测算,本次交易拟发行股份购买资产的发行数量为28,978,455股,不足一股的部分由交易对方无偿赠予上市公司。最终发行数量以中国证监会核准的发行数量为准。具体发行股数如下:
| 序号 | 名称/姓名 | 发行数量(股) |
| 1 | 庄小金 | 12,462,501 |
| 2 | 缪东林 | 2,581,218 |
| 3 | 倍瑞诗 | 9,271,341 |
| 4 | 伊斯源 | 4,663,395 |
| 合计 | 28,978,455 | |
在发行股份购买资产的定价基准日至发行日期间,如上市公司实施现金分红、送红股及资本公积金转增股本等除权、除息事项,则将根据中国证监会及深交所的相关规定对发行数量作相应调整。
五、锁定期安排
本次发行股份购买资产的交易对方对其在本次交易中获得的上市公司股份锁定期安排如下:
庄小金、缪东林因本次发行股份购买资产而获得上市公司的股份(包括在
2-2-248
股份锁定期内因上市公司分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起36个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。
倍瑞诗、伊斯源因本次发行股份购买资产而获得上市公司的股份(包括在股份锁定期内因上市公司分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起12个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。
若上述锁定股份的承诺与证券监管部门的最新监管意见不符的,将按照《证券法》等相关法律法规的规定及相关证券监管部门的最新监管意见锁定。
业绩承诺期内,如前述锁定期届满后,交易对方持有的上市公司向其定向增发的前述股份将继续锁定并按业绩承诺期内各年度业绩累计完成情况分批解锁,各期可解锁股份数量如下:当期可解锁股份数量=上市公司向交易对方定向发行股份数量*截至当期期末累计实现的调整净利润/交易对方于业绩承诺期内承诺的调整净利润总额-累计已经解锁股份,在业绩承诺期结束后,如未达到合计承诺调整净利润但交易对方已经履行完毕全部补偿义务后解锁所有股份。
本次发行完成后,由于上市公司送红股、转增股本等原因而孳息的上市公司股份,亦遵照上述锁定期进行锁定。锁定期届满之后股份的交易按照中国证监会及深交所的有关规定执行。
交易对方因本次交易而获得的股份在锁定期届满后减持还需遵守届时应遵守的法律、深交所相关规则以及上市公司《公司章程》的规定。
六、发行价格调整机制
本次发行股份购买资产的发行价格不设置调整机制。
七、上市地点
本次发行的股份拟在深交所主板上市。
2-2-249
第七节 本次交易合同主要内容
交易双方于2021年4月23日签署了附生效条件的《发行股份及支付现金购买资产协议》及附生效条件的《业绩补偿协议》,于2021年7月13日签署了附生效条件的《发行股份及支付现金购买资产协议之补充协议》及附生效条件的《业绩补偿协议之补充协议》,于2021年7月30日签署了附生效条件的《业绩补偿协议之补充协议(二)》,并于2021年9月30日签署了附生效条件的《发行股份及支付现金购买资产协议之补充协议(二)》。
一、发行股份及支付现金购买资产协议
(一)定义
1、合同主体:北京奥赛康药业股份有限公司(甲方),常州倍瑞诗企业管理有限公司、常州伊斯源企业管理有限公司、庄小金和缪东林(乙方),甲乙两方合称“双方”。
2、“标的公司”指江苏唯德康医疗科技有限公司。
3、“标的资产”指乙方持有的唯德康医疗60%股权。
(二)本次交易方案
双方同意,上市公司拟进行如下交易:甲方以发行股份及支付现金的方式购买乙方合计持有的标的公司60%股权,其中30%股权由甲方向乙方支付现金作为对价支付,其余30%股权由甲方向乙方非公开发行的股份作为对价支付。交割完成后,甲方持有标的公司60%股权。
(三)标的资产及其作价
双方同意,甲方将通过发行股份及支付现金购买资产的方式,向乙方购买其持有的标的公司60%股权,即本次交易项下的标的资产。乙方拥有的拟向甲方转让的部分标的公司股权比例,以及对应标的公司的注册资本如下:
单位:元
| 序号 | 名称/姓名 | 出让的注册资本 | 出让的标的公司股权 |
| 1 | 常州倍瑞诗企业管理有限公司 | 7,858,993.10 | 9.60% |
| 2 | 常州伊斯源企业管理有限公司 | 3,952,997.70 | 4.83% |
2-2-250
| 序号 | 名称/姓名 | 出让的注册资本 | 出让的标的公司股权 |
| 3 | 庄小金 | 28,987,048.30 | 35.40% |
| 4 | 缪东林 | 8,329,016.10 | 10.17% |
| 合计 | 49,128,055.20 | 60.00% | |
经各方协商确定,标的公司100%股权的意向交易作价为139,000万元,对应标的资产的交易价格为83,400万元。
(四)标的资产交易对价支付方式
双方同意,本次交易由甲方购买乙方所持唯德康医疗60%股权,其中30%股权由甲方向乙方之庄小金、缪东林支付现金作为对价支付,其余30%股权由甲方向乙方非公开发行的股份作为对价支付。乙方通过本次交易获得最终股份支付金额和现金金额,具体如下:
| 序号 | 名称/ 姓名 | 出让的注册资本(元) | 出让的标的公司股权 | 交易价格(元) | 发行股份购买部分对应注册资本(元) | 以发行股份方式支付金额(元) | 现金购买部分对应注册资本(元) | 现金支付金额(元) |
| 1 | 倍瑞诗 | 7,858,993.10 | 9.60% | 133,414,608.39 | 7,858,993.10 | 133,414,608.39 | - | - |
| 2 | 伊斯源 | 3,952,997.70 | 4.83% | 67,106,260.74 | 3,952,997.70 | 67,106,260.74 | - | - |
| 3 | 庄小金 | 28,987,048.30 | 35.40% | 492,085,391.61 | 10,564,027.60 | 179,335,391.61 | 18,423,020.70 | 312,750,000.00 |
| 4 | 缪东林 | 8,329,016.10 | 10.17% | 141,393,739.26 | 2,188,009.20 | 37,143,739.26 | 6,141,006.90 | 104,250,000.00 |
| 合计 | 49,128,055.20 | 60.00% | 834,000,000.00 | 24,564,027.60 | 417,000,000.00 | 24,564,027.60 | 417,000,000.00 | |
(五)本次交易项下发行股份及认购
1、定价基准日及发行价格
根据《重组办法》等有关规定并经双方友好协商,定价基准日为甲方关于本次发行股份及支付现金购买资产的董事会决议公告日。本次发行股份的价格为于定价基准日前20个交易日公司股票交易均价。发行价格将提请上市公司股东大会审议确定。
交易均价的计算公式为:董事会决议公告日前20个交易日公司股票交易均价=董事会决议公告日前20个交易日公司股票交易总额/决议公告日前20个交易日公司股票交易总量。
依照前述方式计算,董事会会议决议公告日(2021年4月26日)前20个
2-2-251
交易日股票交易均价为14.59元/股,甲方以此价格向乙方发行股票。
在定价基准日至发行日期间,如上市公司出现派息、送股、资本公积金转增股本等除权除息事项,上市公司将按照深交所相关规则对本次发行价格和发行数量作相应调整,最终发行股数以中国证监会最终核准的股数为准。发行价格的具体调整方法如下:
假设调整前发行价格为P0,每股送股或转增股本数为N,每股配股数为K,配股价为A,每股派息为D,调整后发行价格为P1(调整值保留小数点后两位,最后一位实行四舍五入),则:
派息:P1=P0-D
送股或转增股本:P1=P0/(1+N)
配股:P1=(P0+AK)/(1+K)
假设以上三项同时进行:P1=(P0-D+AK)/(1+K+N)。
2、发行数量
按照甲方以发行股份方式购买的标的公司的30%股权的对价41,700万元以及14.59元/股的发行价格测算,本次交易拟发行股份购买资产发行数量为28,581,218股,不足一股的部分由乙方无偿赠予上市公司。最终发行数量以中国证监会核准的发行数量为准。具体发行股数如下:
| 序号 | 名称/姓名 | 发行数量(股) |
| 1 | 倍瑞诗 | 9,144,250 |
| 2 | 伊斯源 | 4,599,469 |
| 3 | 庄小金 | 12,291,664 |
| 4 | 缪东林 | 2,545,835 |
| 合计 | 28,581,218 | |
在发行股份购买资产的定价基准日至发行日期间,如上市公司实施现金分红、送红股及资本公积金转增股本等除权、除息事项,则将根据中国证监会及深交所的相关规定对发行数量作相应调整。
因上市公司实施2020年年度权益分派方案事项,本次股份发行价格调整为14.39元/股,调整后发行股数合计为28,978,455股
2-2-252
3、锁定期
乙方以其持有的标的公司30%股权认购的甲方股份(包括在股份锁定期内因奥赛康分配股票股利、资本公积转增等衍生取得的股份)将按照《证券法》等相关法律法规的规定及相关证券监管部门的最新监管意见锁定。
乙方同意:业绩承诺期内,如前述锁定期届满,其持有的甲方向其定向增发的前述股份将继续锁定并按业绩承诺期内各年度业绩累计完成情况分批解锁,各期可解锁股份数量如下:当期可解锁股份数量=甲方向乙方定向发行股份数量*截至当期期末累计实现扣除非经常性损益后归属于母公司股东的净利润/乙方于业绩承诺期内承诺的业绩总额-累计已经解锁股份,在业绩承诺期结束后,如未达到合计承诺净利润但乙方已经履行完毕全部补偿义务后解锁所有股份。
本次发行完成后,由于甲方送红股、转增股本等原因而孳息的甲方股份,亦遵照上述锁定期进行锁定。锁定期届满之后股份的交易按照中国证监会及深交所的有关规定执行。
如本次交易因涉嫌所提供或披露的信息存在虚假记载、误导性陈述或者重大遗漏,被司法机关立案侦查或者被中国证监会立案调查的,在案件调查结论明确以前,乙方不转让通过本次交易而取得的上市公司股份。
若上述锁定股份的承诺与证券监管部门的最新监管意见不符的,双方将根据相关证券监管部门的监管意见对上述锁定期约定进行相应调整。
乙方因本次交易而获得的股份在锁定期届满后减持还需遵守届时应遵守的法律、深交所相关规则以及甲方《公司章程》的规定。
(六)现金对价情况
在本协议签署后2日内,甲方向乙方之庄小金、缪东林指定账户支付人民币1,000.00万元(大写人民币壹仟万元整)的保证金。
第一期支付款:甲方召开股东大会后十(10)个工作日内,甲方向乙方之庄小金、缪东林指定账户支付现金人民币8,000.00万元(大写人民币捌仟万元整)作为定金。在本协议约定的发行股份方案取得中国证监会等有权主管部门核准当日,保证金和定金自动转为第一期支付款,具体支付金额如下:
2-2-253
| 序号 | 名称/姓名 | 第一期支付金额(元) |
| 1 | 庄小金 | 67,500,000 |
| 2 | 缪东林 | 22,500,000 |
| 合计 | 90,000,000 | |
第二期支付款:于本协议约定的发行股份方案取得中国证监会等有权主管部门核准通过且标的资产工商过户登记至甲方名下之日起三(3)个工作日内,甲方将乙方之庄小金、缪东林现金对价总额的剩余部分人民币32,700万元(大写人民币叁亿贰仟柒佰万元整),扣除本次交易中甲方应依法代扣代缴乙方之庄小金、缪东林所涉及的税费金额后的剩余部分,支付至乙方之庄小金、缪东林账户。该部分现金对价的具体扣税前金额如下(应代扣代缴税金以税务机关认定为准):
| 序号 | 名称/姓名 | 第二期支付金额(元) |
| 1 | 庄小金 | 245,250,000 |
| 2 | 缪东林 | 81,750,000 |
| 合计 | 327,000,000 | |
(七)过渡期损益
本次交易过渡期产生的损益按有利于保护上市公司和公众股东利益的原则处理:
标的公司于基准日至交割日期间产生的盈利由甲方享有;如发生亏损,则由乙方之各方于审计报告出具之日起十(10)个工作日内向上市公司以现金方式分别补足,乙方之各方就此互相承担无限连带责任。具体金额以具有相关资质的审计机构的审计结果为准。在交割日后三(3)个工作日内,由甲方聘请具备相关资质的会计师事务所对标的公司在过渡期间的损益进行交割审计并出具交割审计报告。
(八)人员安排
双方确认,标的公司及其下属子公司、分公司(如有)现有员工的劳动关系均不因本次交易而发生重大变更,影响标的公司正常经营。
(九)不竞争承诺和竞业禁止
乙方承诺,在本协议签署后三十日内,标的公司及/或附属公司应与现有高
2-2-254
级管理人员签署保密和竞业禁止协议,并维护高级管理人员的稳定。于交割日起3年内,如发生高级管理人员流动(经甲乙双方协商一致的除外),乙方承诺该流动不会对标的公司经营产生重大不利影响。现有高级管理人员在标的公司任职期间,不得在标的公司及其控股子公司之外的公司或企业中担任除董事、监事之外的任何职务,且不得从事或投资与标的公司及/或附属公司相同或类似的业务。服务期满后若离职,离职后的两年内履行竞业禁止义务,不得任职、从事或投资与标的公司及/或附属公司相同或类似的业务。
甲乙双方均不得从事(投资和经营)任何与标的公司业务相竞争的业务。业绩承诺期内,庄小金和缪东林应全职在标的公司工作。
(十)违约责任及补救
除本协议另有约定外,甲方或乙方各方违反本协议中约定的承诺与保证的,违约方应当赔偿守约方包括但不限于直接经济损失在内的全部损失。
于交割完成前,若因甲方单方面终止导致标的资产转让未能完成,乙方可不向甲方退还该定金及保证金。若因乙方中任何一方单方面终止本协议导致本协议约定的标的资产转让未能完成,则乙方应向甲方承担赔偿责任,乙方应当双倍返还该定金及保证金以及相应利息(按同期银行贷款利率计),乙方之各方对此赔偿金额承担无限连带责任。此条款约定自甲方支付定金之日起生效。
于交割日前,若标的公司发生重大不利变化,则甲方有权终止本协议,乙方应向甲方承担赔偿责任。
为免歧义,本协议所述“重大不利变化”指:
(1)标的公司出现季度亏损或连续6个月累计新增亏损达到标的公司2020年末经审计净资产的15%;
(2)标的公司或乙方遭受刑事立案侦查或标的公司受到行政主管部门重大行政处罚;
(3)标的公司或乙方出现欺诈等重大诚信问题(如向甲方提供的财务资料等相关信息存在严重造假或重大遗漏情形)。
2-2-255
(十一)协议的生效、变更和解除
1、生效
双方同意,本协议的生效条件如下:
(1)本协议经双方依法签署;
(2)上市公司董事会、股东大会审议通过本次发行股份及支付现金购买资产的议案;
(3)中国证监会等有权主管部门对本次交易的核准、备案或确认。
2、变更
若本协议所述发行股份方案未获得中国证监会等有权主管部门核准,且未被核准的原因并非为乙方违约导致的标的公司发生重大不利变化时,甲方承诺将于收到该等未获得核准通知后的3个月内,与乙方协商签署完成新的购买资产协议。在该协议内,甲方将承诺以其他方式(包括全部现金收购等)收购标的公司60%股权,并于该协议签订后的24个月内完成该等60%股权的收购事宜。
对本协议任何条款的变更均需以书面形式作出,双方可通过签署补充协议或备忘录的方式对本协议相关条款进行补充约定。
3、解除
除本协议另有约定外,双方一致同意解除本协议时,本协议方可以书面形式解除。
二、发行股份及支付现金购买资产协议之补充协议
(一)定义
各方一致确认,甲方本次收购标的资产的审计、评估基准日为2021年3月31日。
股份支付费用,指标的公司于2021年度实施的股权激励计划,即由倍瑞诗及伊斯源向常州梓熙创业投资合伙企业(有限合伙)和常州梓瀞创业投资合伙企业(有限合伙)合计转让8,188,009.20元出资额,因上述股权激励计划导致标的公司承诺期内分摊产生的股份支付费用总额。
2-2-256
调整净利润,指合并报表中经审计扣除非经常性损益后归属于母公司(唯德康医疗)股东的净利润,加上计入经常性损益的当期股份支付费用后的数额。
本补充协议中所使用的定义、术语和简称,除另有特指外,与《发行股份及支付现金购买资产协议》中相同。
(二)标的资产作价
根据东洲评估出具的东洲评报字【2021】第0759号《评估报告》,截至2021年3月31日,唯德康医疗的净资产评估值为139,100.00万元,对应标的公司60%股权评估值为83,460.00万元。依据上述资产评估结果,协议双方经协商最终确定唯德康医疗60%股权转让的总价款为83,400.00万元。
(三)其他
1、《发行股份及支付现金购买资产协议》“第5.1.6条 发行股份的锁定期和解锁期”的第一段变更为:乙方以其持有的标的公司30%股权认购的甲方股份(包括在股份锁定期内因奥赛康分配股票股利、资本公积转增等衍生取得的股份),若取得该等新股时,持有用于认购该等股份的标的公司的权益时间超过12个月的,则以该部分权益对应的上市公司股份自股份发行完成日起12个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让;若持有用于认购该等股份的标的公司的权益时间不足12个月的,则该部分权益对应的上市公司股份自股份发行完成日起36个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。若上述锁定股份的承诺与证券监管部门的最新监管意见不符的将按照《证券法》等相关法律法规的规定及相关证券监管部门的最新监管意见锁定。
2、《发行股份及支付现金购买资产协议》“第5.1.6条 发行股份的锁定期和解锁期”的第二段变更为:乙方同意:业绩承诺期内,如前述锁定期届满后,其持有的甲方向其定向增发的前述股份将继续锁定并按业绩承诺期内各年度业绩累计完成情况分批解锁,各期可解锁股份数量如下:当期可解锁股份数量=甲方向乙方定向发行股份数量*截至当期期末累计实现的调整净利润/乙方于业绩承诺期内承诺的调整净利润总额-累计已经解锁股份,在业绩承诺期结束后,如未达到合计承诺调整净利润但乙方已经履行完毕全部补偿义务后解锁所有股份。
2-2-257
其他内容不变。
3、本补充协议经协议双方签署后并在下列条件成就时生效:
(1) 本补充协议经双方依法签署;
(2) 上市公司董事会、股东大会审议通过本次发行股份及支付现金购买资产的议案;
(3) 中国证监会等有权主管部门对本次交易的核准、备案或确认。
4、因本补充协议引起的或与本补充协议有关的任何争议,应在双方之间通过友好协商的方式解决;友好协商解决不成的,任何一方可将争议提交上海仲裁委员会,由该仲裁委员会根据仲裁程序进行仲裁。仲裁裁决为终局裁决,对本补充协议双方均有约束力。
5、本补充协议为2021年4月23日签署的《发行股份及支付现金购买资产协议》之补充协议,原《发行股份及支付现金购买资产协议》与本补充协议不一致的,以本补充协议为准。
三、发行股份及支付现金购买资产协议之补充协议(二)
(一)定义
本补充协议中所使用的定义、术语和简称,除另有特指外,与《发行股份及支付现金购买资产协议》和《发行股份及支付现金购买资产协议之补充协议》中相同。
(二)关于未获核准后的进一步约定
《发行股份及支付现金购买资产协议》第12.3条变更如下:
“若本协议5.1条所述发行股份方案未获得中国证监会等有权主管部门核准,甲乙双方进一步约定如下:
(1)若上述发行股份方案未获得中国证监会等有权主管部门核准,且未被核准的原因系因乙方违约导致的标的公司发生重大不利变化(为免歧义,本协议所述“重大不利变化”释义参见本协议第8.3条表述),乙方应于3个月内返还定金及保证金;
2-2-258
(2)若上述发行股份方案未获得中国证监会等有权主管部门核准,且未被核准的原因并非因乙方违约导致的标的公司发生重大不利变化,甲方将于收到未获核准通知后3个月内与乙方协商并签署完成新的购买资产协议;在该协议内,甲方将承诺以其他方式(包括全部现金收购等)收购标的公司60%股权,并于该协议签订后的24个月内完成该等60%股权的收购事宜。在此种情形下,乙方不返还甲方已支付的定金及保证金,甲方已支付的定金及保证金将自动转为新的购买资产协议项下的标的资产交易对价支付款的一部分;
(3)若双方未能在上述新的购买资产协议签订后24个月之内完成收购,则乙方将于前述24个月期满后30日内向甲方全额返还定金和保证金。
‘上述发行股份方案未获得中国证监会等有权主管部门核准’指中国证监会等有权主管部门对上述发行股份方案申请作出不予核准的决定。尽管有本协议第4.1(3)条的约定,本条款相关约定自甲方收到关于上述发行股份方案未获得中国证监会等有权主管部门核准的公告或通知之日起生效。”
(三)股份锁定期安排
《发行股份及支付现金购买资产协议》第5.1.6条变更如下:
“5.1.6 发行股份的锁定期和解锁安排
(1)庄小金、缪东林因本次发行股份购买资产而获得甲方的股份(包括在股份锁定期内因甲方分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起36个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。倍瑞诗、伊斯源因本次发行股份购买资产而获得甲方的股份(包括在股份锁定期内因甲方分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起12个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。若上述锁定股份的承诺与证券监管部门的最新监管意见不符的,将按照《证券法》等相关法律法规的规定及相关证券监管部门的最新监管意见锁定。
(2)业绩承诺期内,如前述锁定期届满后,乙方持有的甲方向其定向增发的前述股份将继续锁定并按业绩承诺期内各年度业绩累计完成情况分批解锁,各期可解锁股份数量如下:当期可解锁股份数量=甲方向乙方定向发行股份数量*
2-2-259
截至当期期末累计实现的调整净利润/乙方于业绩承诺期内承诺的调整净利润总额-累计已经解锁股份,在业绩承诺期结束后,如未达到合计承诺调整净利润但乙方已经履行完毕全部补偿义务后解锁所有股份。
(3)本次发行完成后,由于甲方送红股、转增股本等原因而孳息的甲方股份,亦遵照上述锁定期进行锁定。锁定期届满之后股份的交易按照中国证监会及深交所的有关规定执行。
(4)如本次交易因涉嫌所提供或披露的信息存在虚假记载、误导性陈述或者重大遗漏,被司法机关立案侦查或者被中国证监会立案调查的,在案件调查结论明确以前,乙方不转让通过本次交易而取得的甲方股份。
(5)乙方因本次交易而获得的股份在锁定期届满后减持还需遵守届时应遵守的法律、深交所相关规则以及甲方《公司章程》的规定。”
(四)其他
本补充协议经协议双方签署后并在下列条件成就时生效:
(1)本补充协议经双方依法签署;
(2)上市公司有权机构审议通过关于本补充协议的议案;
(3)中国证监会等有权主管部门对本次交易的核准、备案或确认。
因本补充协议引起的或与本补充协议有关的任何争议,应在双方之间通过友好协商的方式解决;友好协商解决不成的,任何一方可将争议提交上海仲裁委员会,由该仲裁委员会根据仲裁程序进行仲裁。仲裁裁决为终局裁决,对本补充协议双方均有约束力。
本补充协议为2021年4月23日签署的《发行股份及支付现金购买资产协议》和2021年7月13日签署的《发行股份及支付现金购买资产协议之补充协议》之补充协议,原《发行股份及支付现金购买资产协议》和《发行股份及支付现金购买资产协议之补充协议》与本补充协议不一致的,以本补充协议为准。
2-2-260
四、业绩补偿协议
(一)定义
1、合同主体:北京奥赛康药业股份有限公司(甲方),常州倍瑞诗企业管理有限公司、常州伊斯源企业管理有限公司、庄小金和缪东林(乙方),甲乙两方合称“双方”。
2、“标的公司”指江苏唯德康医疗科技有限公司。
3、“标的资产”指乙方持有的唯德康医疗60%股权。
(二)补偿义务
1、业绩承诺期间
业绩承诺期间为本次交易实施完毕当年及其后两个会计年度,即如果本次交易在2021年实施完毕,则业绩承诺期间为2021年、2022年及2023年。若本次交易于2022年实施完成,则承诺期延长至2024年度。
2、业绩承诺内容
乙方向甲方承诺:标的公司在业绩承诺期内的合并报表中经审计扣除非经常性损益后归属于母公司(唯德康医疗)股东的净利润累计不低于36,400万元,具体如下:2021年度至2023年度合并报表中经审计扣除非经常性损益后归属于母公司股东的净利润分别不低于10,000万元、12,000万元、14,400万元。
乙方向甲方承诺:标的公司在承诺期累计实现的实际净利润数(合并报表中经审计扣除非经常性损益后归属于母公司股东的净利润)低于承诺期上述净利润承诺总数的,则乙方应按本协议约定向甲方进行补偿。乙方按照本次交易中各自出让的标的公司股权的相对比例分担,并互相承担连带责任。
若本次交易于2022年实施完成,乙方向甲方承诺2024年度合并报表中经审计扣除非经常性损益后归属于母公司股东的净利润情况及补偿方式,将由甲乙双方另行补充约定。
2-2-261
(三)补偿方式
1、补偿金额及方式
承诺期标的公司累计实现的合并报表中经审计扣除非经常性损益后归属于母公司股东的实际净利润数未达到净利润承诺数的,则上市公司有权要求业绩承诺方优先以其在本次交易中获得的上市公司股份向上市公司进行补偿,不足补偿部分由其以现金方式向上市公司进行补偿:
(1)对于各业绩承诺主体股份补偿部分,奥赛康有权以1元总价的价格予以回购。具体补偿股份数量按以下公式计算确定:
应补偿金额=(承诺期承诺的标的公司净利润数总和-承诺期限内累计实现的标的公司合并报表中经审计扣除非经常性损益后归属于母公司股东的净利润总和)÷承诺期承诺的标的公司净利润数总和×标的资产交易价格
应补偿股份数量=应补偿金额÷本次交易奥赛康向业绩承诺主体发行股份的价格
注:
①根据上述公式计算补偿股份数时,如果计算的补偿股份数小于0时,按0取值。
②上述测算是在假定奥赛康无送红股或公积金转增股本的前提下进行的,如果奥赛康在承诺期实施现金分红、送红股、配股或公积金转增股本等除权除息事项的,则根据上述公式计算的补偿股份数量应换算为除权除息后的股份数量。本协议中补偿或赔偿股份数量的计算均遵循此原则。
(2)业绩承诺主体应先以通过本次交易获得的奥赛康股票进行补偿,超出其通过本次交易获得的股票数量的应补偿股份由业绩承诺主体以现金方式进行补偿,现金补偿金额=超出其通过本次交易获得的股票数量的应补偿股份数×本次交易奥赛康向业绩承诺主体发行股份的价格。
2、补偿程序
在发生乙方因标的公司实现的实际净利润数低于承诺净利润数而需向甲方进行股份及现金(如有)补偿的,乙方在收到甲方书面通知后10个工作日内提
2-2-262
交补偿方案;甲方应在具有相关资质的会计师事务所出具标的公司的专项审计报告后30个工作日内召开董事会及股东大会;甲方董事会及股东大会将审议关于回购乙方应补偿股份并注销的相关方案以及乙方向甲方进行现金补偿(如有)的相关方案(乙方在股东大会审议该事项时应回避表决)。具体实施安排如下:
股份补偿方案:甲方就乙方补偿的股份,采用股份回购注销方案。股份补偿的具体实施安排如下:若甲方股东大会审议通过,则甲方在该股份补偿方案经股东大会审议通过后的10个工作日内通知乙方向甲方实施该股份补偿方案。乙方应在收到甲方书面通知之日起10个工作日内,根据中国证券登记结算有限责任公司深圳分公司的有关规定,并按照甲方要求及时向中国证券登记结算有限责任公司深圳分公司发出将其应补偿的股份,由中国证券登记结算有限责任公司深圳分公司临时保管的指令。且该等股份不拥有表决权,不享有股利分配的权利。
若上述应补偿股份回购并注销事宜获得甲方股东大会审议通过,则甲方将以1元总价回购乙方在业绩承诺期限届满后确定应当补偿的已临时保管的全部股份。
上述股份补偿不足部分由乙方以现金方式向上市公司进行补偿,甲方在该现金补偿方案经股东大会审议通过后的10个工作日内通知乙方向甲方指定账户以现金方式进行补足。
五、业绩补偿协议之补充协议
(一)定义
本补充协议中所使用的定义、术语和简称,除另有特指外,与甲乙双方于2021年4月23日共同签署的《业绩承诺补偿协议》中相同。
股份支付费用,指标的公司于2021年度实施的股权激励计划,即由倍瑞诗及伊斯源向常州梓熙创业投资合伙企业(有限合伙)和常州梓瀞创业投资合伙企业(有限合伙)合计转让8,188,009.20元出资额,因上述股权激励计划导致标的公司承诺期内分摊产生的股份支付费用总额。
调整净利润,指合并报表中经审计扣除非经常性损益后归属于母公司(唯德康医疗)股东的净利润,加上计入经常性损益的当期股份支付费用后的数额。
2-2-263
(二)补偿义务
甲乙双方一致同意:2021年4月23日共同签署的《业绩承诺补偿协议》第
2.2条调整为:
乙方向甲方承诺:标的公司在业绩承诺期内的调整净利润累计不低于36,400万元,具体如下:2021年度至2023年度分别不低于10,000万元、12,000万元、14,400万元。
甲乙双方一致同意:2021年4月23日共同签署的《业绩承诺补偿协议》第
2.3条调整为:
乙方向甲方承诺:标的公司在承诺期累计实现的调整净利润数,低于承诺期上述调整净利润承诺总数的,则乙方应按本协议补充约定向甲方进行补偿。乙方按照本次交易中各自出让的标的公司股权的相对比例分担,并互相承担连带责任。
(三)业绩补偿的方式及实施
甲乙双方一致同意:2021年4月23日签署的《业绩承诺补偿协议》第4.1.1条调整如下:
承诺期标的公司累计实现的调整净利润数未达到调整净利润承诺数的,则上市公司有权要求业绩承诺方优先以其在本次交易中获得的上市公司股份向上市公司进行补偿,不足补偿部分由其以现金方式向上市公司进行补偿:
(1)对于各业绩承诺主体股份补偿部分,奥赛康有权以1元总价的价格予以回购。具体补偿股份数量按以下公式计算确定:
应补偿金额=(承诺期承诺的标的公司调整净利润数总和-承诺期限内累计实现的标的公司调整净利润总和)÷承诺期承诺的标的公司调整净利润数总和×标的资产交易价格
应补偿股份数量=应补偿金额÷本次交易奥赛康向业绩承诺主体发行股份的价格
原4.1.1条的其他内容不变。
2-2-264
(四)减值测试
在业绩承诺期届满时,由甲乙双方共同认可的具有相关资质的会计师事务所对标的资产进行减值测试,并在业绩承诺期限届满当年年度专项审核报告出具后三十个工作日内出具减值测试报告。如减值测试的结果为:期末标的资产减值额大于业绩承诺期内乙方已累计支付的补偿金额,则业绩承诺主体应向甲方进行资产减值的补偿。期末标的资产减值额=标的资产交易价格-期末标的资产评估值(扣除业绩承诺期内标的公司股东增资、减资、接受赠与及利润分配等因素的影响)。
承诺期乙方已支付的补偿金额=承诺期乙方已补偿股份数×本次股份的发行价格+承诺期内乙方已补偿的现金金额。在定价基准日至实际盈利补偿实施日期间,甲方如实施派息、送股、资本公积金转增股本等除权除息事项,本次股份的发行价格将作相应调整。
业绩承诺方向甲方进行资产减值的补偿时,上市公司有权选择要求业绩承诺方按照以现金方式或者股份方式向奥赛康进行补偿:
资产减值需补偿金额=标的资产期末减值额-承诺期乙方已支付的补偿金额。
资产减值应补偿股份数量=资产减值需补偿金额÷本次股份的发行价格。
在定价基准日至资产减值补偿实施日期间,甲方如实施派息、送股、资本公积金转增股本等除权除息事项,本次股份的发行价格将作相应调整。
(五)其他
甲乙双方一致同意:2021年4月23日签署的《业绩承诺补偿协议》中的2.4条、3.1条、4.2条及释义“专项审核报告”中的“净利润”均调整为“调整净利润”。除本补充协议的调整事项外,2021年4月23日签署的《业绩承诺补偿协议》的其它内容不变。
本补充协议自双方签署之日起成立,自发行股份及支付现金购买资产协议及其补充协议全部生效之日起生效。
2-2-265
六、业绩补偿协议之补充协议(二)
(一)定义
本补充协议中所使用的定义、术语和简称,除另有特指外,与甲乙双方于2021年4月23日签署的《业绩补偿协议》、2021年7月13日签署的《业绩补偿协议之补充协议》中相同。
(二)补偿义务
甲乙双方一致同意:若本次交易于2022年实施完成,则业绩承诺期间调整为2022年、2023年及2024年,届时《业绩补偿协议之补充协议》第2.2条将顺延调整为:乙方向甲方承诺:标的公司在业绩承诺期(2022年、2023年及2024年)内的调整净利润累计不低于42,900万元,具体如下:2022年度至2024年度分别不低于12,000万元、14,400万元、16,500万元。
甲乙双方一致同意:《业绩补偿协议》第2.4条调整为:若本次交易于2022年实施完成,则承诺期延长至2024年度,业绩承诺期间为2022年、2023年及2024年,且标的公司2024年度的调整净利润不低于16,500万元。
(三)关于补偿股份
甲乙双方一致同意:《业绩补偿协议》第4.2条第2款调整为:
股份补偿方案:甲方就乙方补偿的股份,采用股份回购注销方案。股份补偿的具体实施安排如下:若甲方股东大会审议通过,则甲方在该股份补偿方案经股东大会审议通过后的10个工作日内通知乙方向甲方实施该股份补偿方案。乙方应在收到甲方书面通知之日起10个工作日内,根据中国证券登记结算有限责任公司深圳分公司的有关规定,并按照甲方要求及时向中国证券登记结算有限责任公司深圳分公司发出将其应补偿的股份,由中国证券登记结算有限责任公司深圳分公司临时保管的指令。自上述股份补偿方案经股东大会审议通过之日至上述应补偿股份注销前,该等股份不拥有表决权、不享有股利分配权、不得质押。
《业绩补偿协议》第4.2条的其他条款不变。
(四)其他
甲乙双方一致同意:除本协议第二条的调整事项外,2021年4月23日签署
2-2-266
的《业绩补偿协议》、2021年7月13日签署的《业绩补偿协议之补充协议》的其它内容不变。
本补充协议自双方签署之日起成立,自发行股份及支付现金购买资产协议及其补充协议全部生效之日起生效。本补充协议为2021年4月23日签署的《业绩补偿协议》、2021年7月13日签署的《业绩补偿协议之补充协议》之补充协议,原《业绩补偿协议》、《业绩补偿协议之补充协议》与本补充协议不致的,以本补充协议为准。
2-2-267
第八节 独立财务顾问核查意见
一、基本假设
本独立财务顾问对本次交易所发表的独立财务顾问意见是基于如下的主要假设:
1、本次交易各方均遵循诚实信用的原则,并按照有关协议条款全面履行其应承担的责任;
2、本报告所依据的资源具备真实性、准确性、完整性和及时性;
3、有关中介机构对本次交易出具的法律、财务审计和评估等文件真实可靠;
4、本次交易所涉及的权益所在地的社会经济环境无重大变化;
5、国家现行法律、法规、政策无重大变化,宏观经济形势不会出现恶化;
6、所属行业的国家政策及市场环境无重大的不可预见的变化;
7、无其它人力不可预测和不可抗力因素造成的重大不利影响。
二、上市公司董事会编制的重组报告书符合《重组管理办法》《若干问题的规定》及《格式准则26号》的要求
上市公司董事会已按照《重组管理办法》《若干问题的规定》及《格式准则26号》等相关规定编制了重组报告书,并经上市公司第五届董事会第十一次会议审议通过。
重组报告书中披露了重大事项提示、重大风险提示、本次交易概况、上市公司基本情况、交易对方基本情况、交易标的基本情况、交易标的评估情况、发行股份情况、本次交易合同主要内容、交易的合规性分析、管理层讨论与分析、财务会计信息、同业竞争和关联交易、风险因素分析、其他重要事项等内容。
经核查,本独立财务顾问认为:上市公司董事会编制的重组报告书符合《重组管理办法》《若干问题的规定》及《格式准则26号》的要求。
2-2-268
三、关于交易对方已根据《若干问题的规定》第一条的要求出具了书面承诺和声明,该等承诺和声明已明确记载于重组报告书中根据《若干问题的规定》第一条规定,“重大资产重组的交易对方应当承诺,保证其所提供信息的真实性、准确性和完整性,保证不存在虚假记载、误导性陈述或者重大遗漏,并声明承担个别和连带的法律责任。该等承诺和声明应当与上市公司董事会决议同时公告。”
本次资产重组交易对方已根据《若干问题的规定》第一条的要求出具书面承诺和声明,保证所提供的信息真实、准确、完整,如因提供的信息存在虚假记载、误导性陈述或者重大遗漏,给上市公司或者投资者造成损失的,将依法承担相应的法律责任。上述承诺已明确记载于《北京奥赛康药业股份有限公司发行股份及支付现金购买资产交易报告书(草案)》中,并将与上市公司董事会决议同时公告。经核查,本独立财务顾问认为:交易对方已根据《若干问题的规定》第一条的要求出具了书面承诺和声明,该等承诺和声明已明确记载于重组报告书中。
四、上市公司已就本次交易与交易对方签订附条件生效的交易合同;交易合同的生效条件符合《若干问题的规定》第二条的要求,交易合同主要条款齐备,交易合同附带的保留条款、补充协议和前置条件不会对本次交易进展构成实质性影响
(一)附条件生效协议的签署情况
上市公司与交易对方签署了附条件生效的《发行股份及支付现金购买资产协议》《发行股份及支付现金购买资产协议之补充协议》《发行股份及支付现金购买资产协议之补充协议(二)》《业绩补偿协议》《业绩补偿协议之补充协议》及《业绩补偿协议之补充协议(二)》。
(二)交易合同的生效条件符合《若干问题的规定》第二条的要求,交易合同主要条款齐备,交易合同附带的先决条件不会对本次交易进展构成实质性影响
根据《若干问题的规定》第二条规定,“上市公司首次召开董事会审议重大
2-2-269
资产重组事项的,应当在召开董事会的当日或者前一日与相应的交易对方签订附条件生效的交易合同。交易合同应当载明本次重大资产重组事项一经上市公司董事会、股东大会批准并经中国证监会核准,交易合同即应生效。重大资产重组涉及发行股份购买资产的,交易合同应当载明特定对象拟认购股份的数量或者数量区间、认购价格或者定价原则、限售期,以及目标资产的基本情况、交易价格或者定价原则、资产过户或交付的时间安排和违约责任等条款。”
1、生效条件
上市公司与交易对方签署的《发行股份及支付现金购买资产协议》、《发行股份及支付现金购买资产协议之补充协议》及《发行股份及支付现金购买资产协议之补充协议(二)》已载明本次交易事项的生效条件为:
(1)本协议经双方依法签署;
(2)上市公司董事会、股东大会审议通过本次发行股份及支付现金购买资产的议案;
(3)中国证监会等有权主管部门对本次交易的核准、备案或确认。
上市公司与交易对方签订的《业绩补偿协议》《业绩补偿协议之补充协议》及《业绩补偿协议之补充协议(二)》自《发行股份及支付现金购买资产协议》、《发行股份及支付现金购买资产协议之补充协议》及《发行股份及支付现金购买资产协议之补充协议(二)》全部生效之日起生效。
《发行股份及支付现金购买资产协议》《发行股份及支付现金购买资产协议之补充协议》《发行股份及支付现金购买资产协议之补充协议(二)》《业绩补偿协议》《业绩补偿协议之补充协议》及《业绩补偿协议之补充协议(二)》的生效条件符合《若干问题的规定》第二条的要求。
2、交易条款对本次交易的影响
本次《发行股份及支付现金购买资产协议》及《发行股份及支付现金购买资产协议之补充协议》《发行股份及支付现金购买资产协议之补充协议(二)》《业绩补偿协议》《业绩补偿协议之补充协议》及《业绩补偿协议之补充协议(二)》
2-2-270
已列明交易对方拟认购股份的数量、认购价格、限售期,以及标的资产的交易价格、定价原则、资产过户或交付的时间安排和违约责任等条款,未附带对于本次交易进展构成实质性影响的保留条款、补充协议和前置条件。经核查,本独立财务顾问认为,上市公司与交易对方签署了附条件生效的《发行股份及支付现金购买资产协议》及《发行股份及支付现金购买资产协议之补充协议》《发行股份及支付现金购买资产协议之补充协议(二)》《业绩补偿协议》《业绩补偿协议之补充协议》及《业绩补偿协议之补充协议(二)》。上述协议符合《若干问题的规定》第二条的要求,主要条款齐备,不存在对于本次交易进展构成实质性影响的保留条款、补充协议和前置条件。
五、关于上市公司董事会已按照《若干问题的规定》第四条的要求对相关事项作出明确判断并记载于董事会决议记录中2021年4月23日,上市公司召开第五届董事会第九次会议审议并通过了《关于本次交易符合<关于规范上市公司重大资产重组若干问题的规定>第四条的议案》,上市公司董事会已按照《若干问题的规定》第四条的规定逐一对相关事项作出了审慎判断并记录于董事会决议记录中。
2021年7月13日,上市公司召开第五届董事会第十一次会议审议并通过了《关于本次交易符合<关于规范上市公司重大资产重组若干问题的规定>第四条的议案》,上市公司董事会已按照《若干问题的规定》第四条的规定逐一对相关事项作出了审慎判断并记录于董事会决议记录中。经核查,本独立财务顾问认为,奥赛康董事会已按照《若干问题的规定》第四条的要求对相关事项作出审慎判断并记载于奥赛康第五届董事会第九次会议决议记录及第五届董事会第十一次会议决议记录中。
2-2-271
六、本次交易合规性分析
(一)本次交易符合《重组管理办法》第十一条规定
1、符合国家产业政策和有关环境保护、土地管理、反垄断等法律和行政法规的规定
(1)本次交易符合国家产业政策
本次交易中,上市公司拟以发行股份及支付现金方式购买庄小金、缪东林、倍瑞诗和伊斯源合计持有的唯德康医疗60%股权,其中以发行股份方式受让前述交易对方持有的唯德康医疗30%的股权,以支付现金的方式受让前述交易对方持有的唯德康医疗30%的股权。本次交易完成后,唯德康医疗将成为上市公司控股子公司。
根据中国证监会发布的《上市公司行业分类指引》(2012年修订),标的公司所属行业为专用设备制造业(C35)。根据国家统计局《国民经济行业分类》(GB/T 4754-2017),标的公司所属行业为专用设备制造业(C35)中的医疗仪器设备及器械制造(C358)。根据2016年3月国务院办公厅发布的《国务院办公厅关于促进医药产业健康发展的指导意见》、2016年10月工信部、国家发改委、科技部、商务部等部委发布的《医药工业发展规划指南》、2017年5月科技部发布的《“十三五”医疗器械科技创新专项规划》、2017年11月国家发改委发布的《增强制造业核心竞争力三年行动计划(2018-2020年)》、2019年9月国家卫健委、国家发改委、教育部、科技部、财政部等部委发布的《健康中国行动——癌症防治实施方案(2019—2022年)》等相关纲要、规划,医疗器械相关行业为我国重点发展产业,标的公司所处行业正受到国家产业政策的鼓励和支持,处于新的发展机遇期,发展前景广阔。
综上所述,本次交易符合国家产业政策。
(2)本次交易符合有关环境保护、土地管理的相关规定
本次交易标的公司所在行业不属于高耗能、重污染行业。报告期内,唯德康医疗及其下属企业未因环境污染问题受到过重大行政处罚,未因本次交易发生违反国家有关环境保护等法律法规规定的行为。
2-2-272
标的公司拥有的土地使用权、房屋所有权情况已在本独立财务顾问报告“第四节 交易标的基本情况”中披露,标的公司报告期内不存在因违反土地管理方面法律法规而受到重大行政处罚的情况,未因本次交易发生违反国家有关土地管理等法律法规规定的行为。综上所述,本次交易符合有关环境保护、土地管理的相关规定。
(3)本次交易符合反垄断的相关规定
根据《国务院关于经营者集中申报标准的规定》第三条的规定,经营者集中达到下列标准之一的,经营者应当事先向国务院商务主管部门申报,未申报的不得实施集中:(一)参与集中的所有经营者上一会计年度在全球范围内的营业额合计超过100亿元人民币,并且其中至少两个经营者上一会计年度在中国境内的营业额均超过4亿元人民币;(二)参与集中的所有经营者上一会计年度在中国境内的营业额合计超过20亿元人民币,并且其中至少两个经营者上一会计年度在中国境内的营业额均超过4亿元人民币。
本次交易未达到《国务院关于经营者集中申报标准的规定》中的计算标准,因此无需向国家市场监督管理总局反垄断局进行申报。本次交易符合反垄断相关法规的规定。
综上,本次交易符合国家产业政策和有关环境保护、土地管理、反垄断等法律和行政法规的规定,符合《重组管理办法》第十一条第(一)项的规定。
2、本次不会导致上市公司不符合股票上市条件
本次交易完成后,上市公司股本总额超过人民币4亿元,且上市公司的社会公众持股比例不低于本次交易后上市公司总股本的10%,上市公司股权分布符合《上市规则》等有关股票上市交易条件的规定。
综上所述,本次交易符合《重组管理办法》第十一条第(二)项的规定。
3、本次重组所涉及的资产定价公允,不存在损害上市公司和股东合法权益的情形
本次交易中,标的资产的交易价格以符合《证券法》规定的资产评估机构出具的评估报告的评估结果为基础,经交易双方充分协商确定。
2-2-273
上市公司董事会审议通过了本次交易相关议案。独立董事对评估机构独立性、评估假设前提合理性、评估方法与评估目的相关性和交易定价公允性发表了独立意见。本次交易相关标的资产的定价依据公允,不存在损害上市公司和股东合法权益的情形。综上所述,本次交易符合《重组管理办法》第十一条第(三)项之规定。
4、本次重组所涉及的资产权属清晰,资产过户或者转移不存在法律障碍,相关债权债务处理合法
本次标的资产为唯德康医疗60%股权。根据交易对方出具的承诺以及标的公司的工商登记资料,标的资产权属清晰,不存在抵押、质押等权利限制或潜在纠纷的情形,不存在涉及诉讼、仲裁、司法强制执行等重大争议或者存在妨碍权属转移的其他情形。本次交易已经由标的公司股东会审议通过,其余股东同意放弃优先受让权,符合标的公司的公司章程规定的股权转让前置条件。本次交易拟购买的标的资产为股权,不涉及债权债务处理或变更事宜。
综上所述,本次交易符合《重组管理办法》第十一条第(四)项之规定。
5、本次重组有利于上市公司增强持续经营能力,不存在可能导致上市公司重组后主要资产为现金或者无具体经营业务的情形
上市公司专注于抗消化道溃疡、抗肿瘤、抗耐药菌感染、慢性病等领域的产品研发、生产、销售。其中,消化道领域产品为公司最主要的收入来源。标的公司是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业。标的公司拥有“久虹”和“唯德康”两个品牌系列产品,围绕内镜诊疗领域进行了系统性的产品布局,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求,具备较强的市场竞争力。通过对标的资产的收购,使上市公司在消化道诊疗领域的布局将更加完善和多元化,在细分领域内的影响力将得到进一步扩展。同时,本次收购有助于上市公司和标的公司进一步丰富产品管线,拓展销售渠道,加速产品商业化进程。
因此,本次交易有利于上市公司增强持续经营能力,不存在可能导致上市公司重组后主要资产为现金或无具体经营业务的情形,符合《重组管理办法》第十一条第(五)项的规定。
2-2-274
6、本次重组有利于上市公司在业务、资产、财务、人员、机构等方面与实际控制人及其关联人保持独立,符合中国证监会关于上市公司独立性的相关规定本次交易前,上市公司控股股东为南京奥赛康,实际控制人为陈庆财。本次交易完成后,上市公司控股股东和实际控制人未发生变化。本次交易前,上市公司在业务、资产、财务、人员、机构等方面与控股股东、实际控制人及其一致行动人及其关联方保持独立。本次交易完成后,上市公司在业务、资产、财务、人员、机构等方面将继续保持独立。因此,本次交易不会对上市公司的独立性造成不利影响,上市公司独立性符合相关规定,本次交易符合《重组管理办法》第十一条第(六)项的规定。
7、本次重组有利于上市公司形成或者保持健全有效的法人治理结构
本次交易前,上市公司已设立股东大会、董事会、监事会等组织机构并制定相应的议事规则,从制度上保证股东大会、董事会和监事会的规范运作和依法行使职责。上市公司已建立了较为完善的法人治理结构,本次交易不会导致上市公司的法人治理结构发生重大变化。本次交易完成后,上市公司将依据《公司法》《证券法》《上市规则》等法律法规的要求,进一步完善公司各项制度的建设和执行,保持健全有效的法人治理结构。
因此,本次交易不会对上市公司的法人治理结构造成不利影响,本次交易符合《重组管理办法》第十一条第(七)项的规定。
(二)本次交易不构成《重组管理办法》第十三条规定的情形
本次交易后,预计南京奥赛康仍为上市公司的控股股东、陈庆财仍为上市公司的实际控制人。本次交易未导致上市公司实际控制权发生变更的情形,因此,本次交易未达到《重组管理办法》第十三条规定的重组上市标准,本次交易不构成重组上市。
因此,本次交易不构成《重组管理办法》第十三条规定的情形。
2-2-275
(三)本次交易符合《重组管理办法》第四十三条规定
1、本次交易有利于提高上市公司资产质量、改善财务状况和增强持续盈利能力本次交易前,上市公司聚焦于消化性溃疡、肿瘤、耐药菌感染、慢性病四大领域,不断提高经营水平和竞争能力。通过本次收购标的公司股权,上市公司新增医疗器械领域布局,在不断巩固现有消化领域的优势地位以外,积极进行医疗器械领域的多元化业务拓展,从而促进上市公司在消化领域的产品结构优化升级。本次交易符合上市公司的发展战略,能够进一步增强上市公司的竞争力,有效提升和稳固市场地位。
本次交易前,上市公司经审计的2020年度归属母公司股东的净利润、基本每股收益、扣除非经常性损益后基本每股收益分别为72,162.51万元、0.78元/股和0.72元/股;2021年1-6月归属母公司股东的净利润、基本每股收益、扣除非经常性损益后基本每股收益分别为26,316.94万元、0.28元/股和0.27元/股。根据立信会计师出具的《备考审阅报告》(信会师报字[2021]第ZA15637号),本次交易完成后,上市公司2020年度归属于母公司的净利润、基本每股收益、扣除非经常性损益后基本每股收益分别为75,835.31万元、0.79元/股和0.74元/股;2021年1-6月归属母公司股东的净利润、基本每股收益、扣除非经常性损益后基本每股收益分别为26,679.22万元、0.28元/股和0.29元/股。
本次交易完成后,上市公司的主营业务突出,资产质量优良,持续经营能力和盈利能力均将得到提升,能够为未来长期稳健发展建立保障,最大程度地保护上市公司全体股东,尤其是广大中小股东的利益。
因此,本次交易有利于提高上市公司资产质量、改善公司财务状况和增强持续盈利能力。
2、本次交易对上市公司关联交易、同业竞争及独立性的影响
(1)本次交易对关联交易的影响
本次交易前,交易对方与上市公司之间不存在关联关系,上市公司已经依照《公司法》《证券法》及中国证监会的相关规定,遵循公开、公平、公正的原则建立健全了关联交易的内部控制制度,明确了关联交易的管理原则、关联方和关
2-2-276
联关系的确认标准及要求、关联交易的决策权限和审议程序,并在关联交易审议过程中严格实施关联董事和关联股东回避表决制度。本次交易完成后,交易对方持有上市公司股权比例均低于5%,不构成上市公司关联方,唯德康医疗成为上市公司控股子公司,预计不会产生新的关联交易。上市公司将继续严格按照相关法律、法规的规定及上市公司的相关规定,加强对关联交易内部控制,完善公司治理,维护上市公司及股东尤其是中小股东的合法权益。
为保证未来能减少和规范关联交易,保护上市公司全体股东,特别是中小股东的合法权利,上市公司控股股东、实际控制人及其一致行动人及本次交易对方均出具了《关于减少和规范关联交易的承诺函》。
(2)本次交易对同业竞争的影响
本次交易前,上市公司控股股东为南京奥赛康,实际控制人为陈庆财。本次交易完成后,上市公司控股股东和实际控制人未发生变化,主营业务未发生重大变化,与控股股东、实际控制人及其控制的其他企业不存在同业竞争。
为保证未来能避免同业竞争情形,保护上市公司全体股东,特别是中小股东的合法权利,上市公司控股股东、实际控制人及其一致行动人及本次交易对方均出具了《关于避免同业竞争的承诺函》。
(3)本次交易对独立性的影响
本次交易前,上市公司在业务、资产、财务、人员、机构等方面与控股股东、实际控制人及其一致行动人及其关联方保持独立。本次交易完成后,上市公司在业务、资产、财务、人员、机构等方面将继续保持独立。为了维护上市公司经营的独立性,上市公司控股股东、实际控制人及其一致行动人出具了《关于保证上市公司独立性的承诺函》。
因此,本次交易有利于上市公司减少关联交易、避免同业竞争、增强独立性。
3、上市公司最近一年财务会计报告经注册会计师出具无保留意见审计报告
根据立信会计师事务所(特殊普通合伙)出具的上市公司2020年《审计报告》(信会师报字[2021]第ZA11988号),注册会计师对上市公司最近一年财务
2-2-277
会计报告出具了标准无保留意见的审计报告,不存在被出具保留意见、否定意见或者无法表示意见的审计报告的情形。
4、上市公司及其现任董事、高级管理人员不存在因涉嫌犯罪正被司法机关立案侦查或涉嫌违法违规正被中国证监会立案调查的情形根据上市公司及其现任董事、高级管理人员出具的说明及公开网络查询,截至本独立财务顾问报告出具日,上市公司及其现任董事、高级管理人员不存在因涉嫌犯罪正被司法机关立案侦查或涉嫌违法违规正被中国证监会立案调查的情形。
5、上市公司发行股份所购买的资产为权属清晰的经营性资产,并能在约定期限内办理完毕权属转移手续
本次交易的标的资产为唯德康医疗60%股权,该资产为权属清晰的经营性资产,不存在冻结、质押等限制权利行使的情形,资产过户或者转移不存在法律障碍,预计能在约定期限内办理完毕权属转移手续。
(四)本次交易符合《重组管理办法》第四十五条规定
经交易各方协商一致,本次发行股份购买资产的股份发行价格为于定价基准日前20个交易日公司股票交易均价,为14.59元/股。因上市公司实施2020年年度权益分派方案事项,本次股份发行价格调整为14.39元/股,本次发行价格已经上市公司2021年第一次临时股东大会审议确定。本次发行股份的价格不低于市场参考价的90%,即本次交易的首次董事会决议公告日(2021年4月26日)前20个交易日、60个交易日或者120个交易日的公司股票交易均价之一,符合《重组管理办法》第四十五条规定。
(五)本次交易符合《重组管理办法》第四十六条规定
根据上市公司与交易对方签署的《发行股份及支付现金购买资产协议》及其补充协议、交易对方出具的股份锁定承诺,交易对方已作出相应的股份锁定承诺,具体详见本独立财务顾问报告 “第一节 本次交易概况”之“二、本次交易具体方案”之“(一)发行股份购买资产”之“5、锁定期安排”。该等股份锁定承诺符合《重组管理办法》第四十六条之规定。
2-2-278
(六)上市公司不存在《上市公司证券发行管理办法》第三十九条规定的不得非公开发行股票的情形
上市公司不存在《上市公司证券发行管理办法》第三十九条规定的不得非公开发行股票的情形:
1、本次发行申请文件不存在虚假记载、误导性陈述或重大遗漏;
2、不存在上市公司的权益被控股股东或实际控制人严重损害且尚未消除的情形;
3、不存在上市公司及其附属公司违规对外提供担保且尚未解除的情形;
4、不存在上市公司现任董事、高级管理人员最近三十六个月内受到过中国证监会的行政处罚,或者最近十二个月内受到过证券交易所公开谴责的情形;
5、不存在上市公司或其现任董事、高级管理人员因涉嫌犯罪正被司法机关立案侦查或涉嫌违法违规正被中国证监会立案调查的情形;
6、不存在最近一年及一期财务报表被注册会计师出具保留意见、否定意见或无法表示意见的审计报告的情形;
7、不存在严重损害投资者合法权益和社会公共利益的其他情形。
经核查,本独立财务顾问认为,本次交易中上市公司不存在《上市公司证券发行管理办法》第三十九条规定的不得非公开发行股票的情形。
七、对本次交易所涉及的资产定价公平合理性的核查
本次交易中,根据东洲资产评估出具的东洲评报字【2021】第0759号《资产评估报告》,以2021年3月31日为基准日,标的公司和标的资产的评估情况如下:
单位:万元
| 评估方法 | 股东权益 账面价值 | 股东权益 评估价值 | 评估增减值 | 增减值 | 收购 比例 | 标的资产 评估价值 |
| A | B | C=B-A | D=C/A ×100% | |||
| 资产基础法 | 19,383.90 | 33,995.03 | 14,611.14 | 75.38% | 60.00% | 83,460.00 |
| 收益法 | 139,100.00 | 119,716.10 | 617.61% |
本次评估采用资产基础法和收益法进行评估,并以收益法评估结果作为标的
2-2-279
资产的最终评估结论。在最终采用的收益法评估下唯德康医疗股东全部权益价值的评估值为139,100.00万元,较唯德康医疗经审计后母公司账面股东权益19,383.90万元增值119,716.10万元,增值率617.61%。对应标的资产评估值为83,460.00万元。
以上述评估结果为基础,经交易双方充分协商确定,以2021年3月31日作为基准日,标的公司100%股权的评估值为139,100.00万元,对应标的公司60%股权评估值为83,460.00万元,经友好协商,双方确定本次交易作价为83,400.00万元。
(一)标的资产定价的合理性
1、与同行业上市公司比较
标的公司主要从事消化内镜领域医疗器械研发、生产、销售,根据中国证监会发布的《上市公司行业分类指引》(2012年修订),标的公司所属行业为专用设备制造业(C35)。通过选取行业中与标的公司同处于“专用设备制造业”且主营业务相似的上市公司作为标的公司的可比上市公司,可比上市公司截至本次交易的评估基准日,即2021年3月31日的估值情况如下:
| 证券代码 | 证券简称 | 市盈率(TTM) | 市盈率(LYR) |
| 688029.SH | 南微医学 | 94.75 | 81.25 |
| 300003.SZ | 乐普医疗 | 27.94 | 30.66 |
| 603309.SH | 维力医疗 | 20.96 | 27.06 |
| 688677.SH | 海泰新光 | 67.96 | 67.96 |
| 300529.SZ | 健帆生物 | 77.83 | 106.39 |
| 可比公司平均值 | 57.89 | 62.66 | |
| 可比公司中位数 | 67.96 | 67.96 | |
| 唯德康医疗动态市盈率 | 11.46 | ||
| 唯德康医疗静态市盈率 | 15.65 | ||
数据来源:WIND资讯注1:同行业可比公司市盈率(TTM)=该公司2021年3月31日市值/该公司最新报告期前推12个月(完整年度)的归母净利润注2:同行业可比公司市盈率(LYR)=该公司2021年3月31日市值/该公司2020年归母净利润注3:唯德康医疗动态市盈率=唯德康医疗100%股权作价/2021年至2023年平均承诺净利润注4:唯德康医疗静态市盈率=唯德康医疗100%股权作价/唯德康医疗2020年经审计归母净利润
2-2-280
上述可比公司平均市盈率(TTM)为57.89倍,中位数为67.96倍,平均市盈率(LYR)为62.66倍,中位数为67.96倍。本次交易中,标的公司动态市盈率为11.46倍,静态市盈率为15.65倍,低于可比上市公司平均值及中值。
2、与同行业可比交易比较
从业务性质及本次交易的可比性角度,通过选取2018年以来上市公司收购医疗器械企业的交易案例,其中与本次交易具有相似性的可比交易,其估值情况如下:
| 证券代码 | 证券简称 | 收购标的 | 评估基准日 | 静态PE | 动态PE |
| 300341.SZ | 麦克奥迪 | 麦迪医疗80%股权 | 2017/12/31 | 44.27 | 19.06 |
| 603309.SH | 维力医疗 | 狼和医疗100%股权 | 2017/12/31 | 14.07 | 10.19 |
| 002082.SZ | 万邦德 | 康慈医疗80%股权 | 2018/5/31 | 39.57 | 14.01 |
| 300453.SZ | 三鑫医疗 | 宁波菲拉尔51%股权 | 2018/12/31 | 9.55 | 8.00 |
| 002382.SZ | 蓝帆医疗 | 武汉必凯尔100%股权 | 2019/6/30 | 16.34 | 12.61 |
| 600538.SH | 国发股份 | 高盛生物99.9779%股权 | 2019/12/31 | 15.61 | 12.71 |
| 可比交易平均值 | 23.24 | 12.76 | |||
| 可比交易中位数 | 15.97 | 12.66 | |||
| 002755.SZ | 奥赛康 | 唯德康医疗60%股权 | 2021/3/31 | 15.65 | 11.46 |
数据来源:WIND资讯注1:动态市盈率=交易标的100%股权作价/业绩承诺期平均承诺净利润注2:静态市盈率=交易标的 100%股权作价/业绩承诺期前一年经审计归母净利润
上述可比交易平均静态市盈率为23.24倍,中位数为15.97倍,平均动态市盈率为12.76倍,中位数为12.66倍。本次交易中,标的公司静态市盈率为15.65倍,低于可比交易平均值及中值。动态市盈率为11.46倍,低于可比交易平均值及中值。
综上,本次交易的评估定价具备公允性,有利于保护中小股东的利益。
(二)发行股份定价的合理性
本次发行股份购买资产涉及的定价基准日为上市公司本次发行股份及支付现金购买资产的首次董事会决议公告日,即2021年4月26日。经计算,上市公司本次发行股份购买资产可选择的市场参考价为:
| 董事会决议公告日 | 前20个交易日 | 前60个交易日 | 前120个交易日 |
2-2-281
| 董事会决议公告日 | 前20个交易日 | 前60个交易日 | 前120个交易日 |
| 市场参考价(元/股) | 14.59 | 14.02 | 14.51 |
| 市场参考价的90%(元/股) | 13.13 | 12.62 | 13.06 |
交易均价的计算公式为:董事会决议公告日前若干个交易日公司股票交易均价=决议公告日前若干个交易日公司股票交易总额/决议公告日前若干个交易日公司股票交易总量。经交易各方协商一致,本次发行股份购买资产的股份发行价格为于定价基准日前20个交易日公司股票交易均价,为14.59元/股。因上市公司实施2020年年度权益分派方案事项,本次股份发行价格调整为14.39元/股,本次发行价格已经上市公司2021年第一次临时股东大会审议确定。
上市公司发行股份购买资产的发股定价原则符合《重组管理办法》的相关规定,即上市公司发行股份的价格不得低于市场参考价的90%。市场参考价为本次交易的董事会决议公告日前20个交易日、60个交易日或者120个交易日的公司股票交易均价之一。
经核查,本独立财务顾问认为,资产定价具备合理性及公允性,有利于保护中小股东的利益。同时发行股份价格定价符合相关法律、法规的规定,不存在损害上市公司或其股东的合法权益的情形。
八、本次交易根据资产评估结果定价,对所选取的评估方法的适当性、评估假设前提的合理性、重要评估参数取值的合理性发表明确意见
(一)评估方法的适当性
依据资产评估准则的规定,执行企业价值评估业务可以采用收益法、市场法、资产基础法三种基本方法。收益法是指将预期收益资本化或者折现,确定评估对象价值的评估方法。对企业价值评估采用收益法,强调的是企业的整体预期盈利能力。市场法是指将评估对象与可比上市公司或者可比交易案例进行比较,确定评估对象价值的评估方法。资产基础法是指以被评估单位评估基准日的资产负债表为基础,合理评估企业表内及可识别的表外各项资产、负债价值,确定评估对象价值的评估方法。对企业价值评估采用资产基础法,可能存在并非每项资产和负债都可以被充分识别并单独评估价值的情形。
2-2-282
本次评估的目的是购买股权,针对评估方法的选择有以下考虑:
资产基础法的基本思路是按现行条件重建或重置被评估资产,潜在的投资者在决定投资某项资产时,所愿意支付的价格不会超过购建该项资产的现行购建成本。本评估项目能满足资产基础法评估所需的条件,即被评估资产处于继续使用状态或被假定处于继续使用状态,具备可利用的历史经营资料。采用资产基础法可以满足本次评估的价值类型的要求。收益法是从资产的预期获利能力的角度评价资产,能完整体现企业的整体价值,其评估结果具有较好的可靠性和说服力。同时,被评估单位具备了应用收益法评估的前提条件:未来可持续经营、未来收益期限可以预计、股东权益与企业经营收益之间存在稳定的关系、未来经营收益可以预测量化、与企业预期收益相关的风险报酬能被估算计量。因此本次具备采用收益法评估的基本条件。市场法常用的两种具体方法是上市公司比较法和交易案例比较法,适用市场法的前提条件是存在一个发育成熟、公平活跃的公开市场,且市场数据比较充分,在公开市场上有可比的交易案例。经查询与被评估单位同一行业的国内上市公司,在产品类型、经营模式、企业规模、资产配置、未来成长性等方面具备可予比较的上市公司很少;且近期产权交易市场类似行业特征、经营模式的股权交易较少,相关交易背景、交易案例的经营财务数据等信息无法从公开渠道获得,不具备采用市场法评估的基本条件。
综上,本次评估确定采用资产基础法和收益法进行评估。
本独立财务顾问认为:本次评估采用收益法和资产基础法两种方法进行评估,评估方法具备适用性。
(二)评估假设前提的合理性
东洲评估对标的公司所设定的评估假设前提和限制条件按照国家有关法规和规定执行,遵循了市场通用的惯例或准则,符合评估对象的实际情况,评估假设前提具有合理性。
本独立财务顾问认为:本次评估的假设前提合理。
2-2-283
(三)重要评估参数取值的合理性、预期收益的可实现性
本次交易对标的资产重要评估参数取值的合理性分析请参见本独立财务顾问报告“第五节 交易标的评估情况”。
本次评估实施了必要的评估程序,遵循了独立性、客观性、科学性、公正性等原则,评估结果客观、公正地反映了评估基准日评估对象的实际状况,各类资产的评估方法适当,本次评估结论具有公允性。本次拟交易标的资产以评估值作为定价的基础,交易价格公平、合理,不会损害公司及广大中小股东利益。
经核查,本独立财务顾问认为,本次交易的评估假设前提合理,评估方法与评估目的相关一致,评估方法选取适当合理,重要评估参数选取合理,预期收益可实现,本次交易评估定价公允,不存在损害上市公司及其股东、特别是中小股东利益的情形。
九、结合上市公司管理层讨论与分析,分析说明本次交易完成后上市公司的盈利能力和财务状况、本次交易是否有利于上市公司的持续发展、是否存在损害股东合法权益的问题
(一)本次交易前后上市公司盈利能力和财务状况比较
根据上市公司未经审计的2021年1-6月财务报表、经审计的2020年财务报表以及经审阅的备考财务报表,上市公司最近一年一期主要财务数据比较如下:
单位:万元
| 项目 | 2021年6月30日/ 2021年1-6月 | 2020年12月31日/ 2020年度 | ||
| 未审数 | 备考数 | 审定数 | 备考数 | |
| 总资产 | 355,879.79 | 462,670.16 | 380,809.94 | 486,570.24 |
| 归属于上市公司股东的所有者权益 | 310,400.48 | 351,986.45 | 302,715.13 | 336,032.85 |
| 归属于上市公司股东的每股净资产(元/股) | 3.34 | 3.68 | 3.26 | 3.51 |
| 营业收入 | 167,404.96 | 189,231.11 | 378,268.89 | 415,681.39 |
| 归属于上市公司股东的净利润 | 26,316.94 | 26,679.22 | 72,162.51 | 75,835.31 |
| 基本每股收益 (元/股) | 0.28 | 0.28 | 0.78 | 0.79 |
2-2-284
| 项目 | 2021年6月30日/ 2021年1-6月 | 2020年12月31日/ 2020年度 | ||
| 未审数 | 备考数 | 审定数 | 备考数 | |
| 基本每股收益(扣非后)(元/股) | 0.27 | 0.29 | 0.72 | 0.74 |
本次交易前,上市公司2020年度基本每股收益为0.78元/股,本次交易完成后,上市公司2020年备考基本每股收益为0.79元/股,每股收益得到增厚,本次交易进一步提升了上市公司的盈利能力。
本次交易前,上市公司2021年1-6月基本每股收益为0.28元/股,基本每股收益(扣非后)为0.27元/股;本次交易完成后,上市公司2021年1-6月备考基本每股收益为0.28元/股,备考基本每股收益(扣非后)为0.29元/股,从基本每股收益来看,除去四舍五入的因素,本次交易前,上市公司2021年1-6月基本每股收益为0.2835元/股,本次交易后,上市公司2021年1-6月备考基本每股收益为0.2787元/股,短期内上市公司2021年1-6月基本每股收益被摊薄,主要原因系标的公司于2021年3月内部重组时因非同比例增资导致一次性确认了3,616.67万元计入非经常性损益的股份支付费用,扣除该等非经常性损益因素后,备考基本每股收益(扣非后)有所上升,本次交易总体上有利于增强上市公司的盈利能力。
(二)本次交易完成后,上市公司持续盈利能力分析
本次交易前,上市公司专注于抗消化道溃疡、抗肿瘤、抗耐药菌感染、慢性病等领域的产品研发、生产、销售,其中,消化道领域药品为公司最主要的收入来源。
本次交易标的公司唯德康医疗是一家专业从事消化内镜领域医疗器械研发、生产、销售的高新技术企业。标的公司拥有“久虹”和“唯德康”两个品牌系列产品,围绕内镜诊疗领域进行了系统性的产品布局,丰富的产品管线能够满足消化内镜诊疗领域的各种临床需求,具备较强的市场竞争力。
本次交易后,上市公司将持有唯德康医疗60%股权。上市公司在消化道领域药品业务基础上将产业链进一步延伸,新增内镜介入诊疗器械的研发、生产和销售业务,从而进一步拓宽收入来源,提升上市公司的盈利能力,分散经营风险,上市公司的资产质量及盈利能力都将得到提升,提高了上市公司可持续发展能
2-2-285
力,为整体经营业绩提升提供保证,符合上市公司全体股东的利益。此外,标的公司能够借助上市公司平台提升自身的融资能力和品牌实力,实现业务的快速发展,并利用上市公司的管理经验,优化公司治理结构、提升管理运营效率,助力标的公司整体竞争力提升,实现快速发展。
同时,根据交易对方的业绩承诺,标的公司在业绩承诺期内的调整净利润累计不低于36,400万元,具体如下:2021年度至2023年度分别不低于10,000万元、12,000万元、14,400万元。若本次交易于2022年实施完成,标的公司在业绩承诺期(2022年、2023年及2024年)内的调整净利润累计不低于42,900万元,具体如下:2022年度至2024年度分别不低于12,000万元、14,400万元、16,500万元。未来如业绩承诺按期实现,上市公司净利润水平将得到一定提升。综上,本次交易有利于改善公司财务状况,拓宽收入来源,寻求新的利润增长点,提升公司盈利能力,增强公司持续经营能力。
经核查,本独立财务顾问认为,本次交易完成后上市公司的盈利能力和财务状况将得到改善,本次交易有利于上市公司的持续发展,不存在损害股东合法权益的情况。
十、对交易完成后上市公司的市场地位、经营业绩、持续发展能力、公司治理机制进行全面分析
本次交易完成后,唯德康医疗将成为上市公司的控股子公司,纳入上市公司的管理范围。本次交易的标的公司与上市公司共同专注于消化领域产品的研发、生产和销售,交易完成后,上市公司新增医疗器械领域布局,促进消化领域产品结构优化升级,符合上市公司的发展战略,能够进一步增强上市公司的竞争力,有效提升和稳固市场地位。
本次交易完成后,上市公司将注入医疗器械优质资产,上市公司将利用自身在药物领域优势,推动整合并共享相关优质医疗资源,充分发挥协同效应,持续提升盈利能力与增强综合竞争力。双方未来预计能够在研发与技术、生产与供应链、市场开拓能力等方面产生协同效应。上市公司将在保持标的公司独立运营的基础上,与标的公司实现优势互补,对业务、资产、团队、管理等方面进行整合,双方能够在产品结构、技术开发、客户资源等各方面产生协同效应。
2-2-286
经核查,本独立财务顾问认为:本次交易完成后,上市公司经营业绩和持续发展能力将得到提升、公司治理机制健全发展,符合《上市公司治理准则》的要求。
十一、对交易合同约定的资产支付安排是否可能导致上市公司支付现金或其他资产后不能及时获得对价的风险、相关的违约责任是否切实有效,发表明确意见
1、资产交割过渡期安排
根据《发行股份及支付现金购买资产协议》,本次交易过渡期产生的损益按有利于保护上市公司和公众股东利益的原则处理:
标的公司于基准日至交割日期间产生的盈利由上市公司享有;如发生亏损,则由交易对方之各方于审计报告出具之日起十(10)个工作日内向上市公司以现金方式分别补足,交易对方之各方就此互相承担无限连带责任。具体金额以具有相关资质的审计机构的审计结果为准。在交割日后三(3)个工作日内,由上市公司聘请具备相关资质的会计师事务所对标的公司在过渡期间的损益进行交割审计并出具交割审计报告。
2、资产支付安排
交易各方在《发行股份及支付现金购买资产协议》中对违约责任约定如下:
除非本协议各方就交割启动时点另有约定,现金交易部分的标的公司30%股权将与股份交易部分的标的公司30%股权一起,于发行股份方案取得中国证监会等有权主管部门核准后两(2)个月内办理完成工商转让过户手续。
除非各方另有约定,如在本次交易获得中国证监会核准之日起三(3)个月届满之日,乙方及标的公司仍未能完成前款所述60%股权的工商登记变更,甲方有权选择继续或者终止本次股权交易。
于交割日后三(3)个工作日内,上市公司应聘请具备相关资质的会计师事务所就交易对方以标的公司60%股权认购甲方发行股份涉及的标的资产交割事项进行验资并出具验资报告。在上市公司聘请的具备相关资质的会计师事务所出具前述验资报告后二十(20)个工作日内,交易各方向结算公司申请办理将向交
2-2-287
易对方发行的新增股份登记至交易对方名下的手续。交易各方同意,为实现标的资产的交割以及拟发行股份的相关登记手续,各方将密切合作并采取一切必要的行动。
3、违约责任安排
交易各方在《发行股份及支付现金购买资产协议》中对违约责任约定如下:
上市公司或交易对方各方违反《发行股份及支付现金购买资产协议》中约定的承诺与保证的,违约方应当赔偿守约方包括但不限于直接经济损失在内的全部损失。于交割完成前,若因上市公司单方面终止导致标的资产转让未能完成,交易对方可不向上市公司退还该定金及保证金。若因交易对方中任何一方单方面终止《发行股份及支付现金购买资产协议》导致该协议约定的标的资产转让未能完成,则交易对方应向上市公司承担赔偿责任,交易对方应当双倍返还该定金及保证金以及相应利息(按同期银行贷款利率计),交易对方之各方对此赔偿金额承担无限连带责任。此条款约定自上市公司支付定金之日起生效。于交割日前,若标的公司发生重大不利变化,则上市公司有权终止《发行股份及支付现金购买资产协议》,交易对方应向上市公司承担赔偿责任,重大不利变化指:
(1)标的公司出现季度亏损或连续6个月累计新增亏损达到标的公司2020年末经审计净资产的15%;
(2)标的公司或交易对方遭受刑事立案侦查或标的公司受到行政主管部门重大行政处罚;
(3)标的公司或交易对方出现欺诈等重大诚信问题(如向上市公司提供的财务资料等相关信息存在严重造假或重大遗漏情形)。
经核查,本独立财务顾问认为:本次交易约定的资产交付安排不会导致上市公司交付现金或其他资产后不能及时获得对价的风险,相关违约责任切实有效。
2-2-288
十二、本次交易是否构成关联交易的核查
本次交易前,交易对方与上市公司不存在关联关系。本次交易完成后,各交易对方持有上市公司股份均低于5%。因此,本次交易不构成关联交易。
经核查,本独立财务顾问认为:本次交易不构成关联交易。
十三、交易对方与上市公司根据《重组管理办法》第三十五条的规定,就相关资产实际盈利数不足利润预测数的情况签订补偿协议的,独立财务顾问应当对补偿安排的可行性、合理性发表意见
(一)业绩承诺及补偿
1、业绩承诺期间
业绩承诺期间为本次交易实施完毕当年及其后两个会计年度,即如果本次交易在2021年实施完毕,则业绩承诺期间为2021年、2022年及2023年。若本次交易于2022年实施完成,则承诺期延长至2024年度。
2、业绩承诺内容
标的公司在业绩承诺期内的调整净利润累计不低于36,400万元,具体如下:
2021年度至2023年度分别不低于10,000万元、12,000万元、14,400万元。若本次交易于2022年实施完成,标的公司在业绩承诺期(2022年、2023年及2024年)内的调整净利润累计不低于42,900万元,具体如下:2022年度至2024年度分别不低于12,000万元、14,400万元、16,500万元。其中:
调整净利润,指合并报表中经审计扣除非经常性损益后归属于母公司(唯德康医疗)股东的净利润,加上计入经常性损益的当期股份支付费用后的数额。
股份支付费用,指标的公司于2021年度实施的股权激励计划,即由倍瑞诗及伊斯源向常州梓熙和常州梓瀞创合计转让8,188,009.20元出资额,因上述股权激励计划导致标的公司承诺期内分摊产生的股份支付费用总额。
3、业绩补偿方式
承诺期标的公司累计实现的调整净利润数未达到调整净利润承诺数的,则上市公司有权要求业绩承诺方优先以其在本次交易中获得的上市公司股份向上市
2-2-289
公司进行补偿,不足补偿部分由其以现金方式向上市公司进行补偿:
(1)对于各业绩承诺主体股份补偿部分,奥赛康有权以1元总价的价格予以回购。具体补偿股份数量按以下公式计算确定:
应补偿金额=(承诺期承诺的标的公司调整净利润数总和-承诺期限内累计实现的标的公司调整净利润总和)÷承诺期承诺的标的公司调整净利润数总和×标的资产交易价格
应补偿股份数量=应补偿金额÷本次交易奥赛康向业绩承诺主体发行股份的价格
(2)业绩承诺主体应先以通过本次交易获得的奥赛康股票进行补偿,超出其通过本次交易获得的股票数量的应补偿股份由业绩承诺主体以现金方式进行补偿,现金补偿金额=超出其通过本次交易获得的股票数量的应补偿股份数×本次交易奥赛康向业绩承诺主体发行股份的价格。
(二)减值测试及补偿
在业绩承诺期届满时,由甲乙双方共同认可的具有相关资质的会计师事务所对标的资产进行减值测试,并在业绩承诺期限届满当年年度专项审核报告出具后三十个工作日内出具减值测试报告。如减值测试的结果为:期末标的资产减值额大于业绩承诺期内乙方已累计支付的补偿金额,则业绩承诺主体应向甲方进行资产减值的补偿。
期末标的资产减值额=标的资产交易价格—期末标的资产评估值(扣除业绩承诺期内标的公司股东增资、减资、接受赠与及利润分配等因素的影响)。
承诺期乙方已支付的补偿金额=承诺期乙方已补偿股份数×本次股份的发行价格+承诺期内乙方已补偿的现金金额。在定价基准日至实际盈利补偿实施日期间,甲方如实施派息、送股、资本公积金转增股本等除权除息事项,本次股份的发行价格将作相应调整。
业绩承诺方向甲方进行资产减值的补偿时,上市公司有权选择要求业绩承诺方按照以现金方式或者股份方式向奥赛康进行补偿:
资产减值需补偿金额=标的资产期末减值额—承诺期乙方已支付的补偿金
2-2-290
额。资产减值应补偿股份数量=资产减值需补偿金额÷本次股份的发行价格。在定价基准日至资产减值补偿实施日期间,甲方如实施派息、送股、资本公积金转增股本等除权除息事项,本次股份的发行价格将作相应调整。
(三)补偿方案的实施
在发生交易对方因标的公司实现的实际净利润数低于承诺净利润数而需向上市公司进行股份及现金(如有)补偿的,交易对方在收到上市公司书面通知后10个工作日内提交补偿方案;上市公司应在具有相关资质的会计师事务所出具标的公司的专项审计报告后30个工作日内召开董事会及股东大会;上市公司董事会及股东大会将审议关于回购交易对方应补偿股份并注销的相关方案以及交易对方向上市公司进行现金补偿(如有)的相关方案(交易对方在股东大会审议该事项时应回避表决)。具体实施安排如下:
股份补偿方案:上市公司就交易对方补偿的股份,采用股份回购注销方案。股份补偿的具体实施安排如下:
若上市公司股东大会审议通过,则上市公司在该股份补偿方案经股东大会审议通过后的10个工作日内通知交易对方向上市公司实施该股份补偿方案。交易对方应在收到上市公司书面通知之日起10个工作日内,根据中国证券登记结算有限责任公司深圳分公司的有关规定,并按照上市公司要求及时向中国证券登记结算有限责任公司深圳分公司发出将其应补偿的股份,由中国证券登记结算有限责任公司深圳分公司临时保管的指令。且该等股份不拥有表决权,不享有股利分配的权利。
若上述应补偿股份回购并注销事宜获得上市公司股东大会审议通过,则上市公司将以1元总价回购交易对方在业绩承诺期限届满后确定应当补偿的已临时保管的全部股份。
上述股份补偿不足部分由交易对方以现金方式向上市公司进行补偿,上市公司在该现金补偿方案经股东大会审议通过后的10个工作日内通知交易对方向上市公司指定账户以现金方式进行补足。
2-2-291
(四)承诺方保障业绩补偿实现的具体安排及承诺
1、关于股份锁定的安排
根据上市公司与交易对方签署的《发行股份及支付现金购买资产协议》及其补充协议、《业绩补偿协议》及其补充协议、交易对方出具的相关承诺函,本次发行股份购买资产取得的股份锁定安排具体如下:
庄小金、缪东林因本次发行股份购买资产而获得上市公司的股份(包括在股份锁定期内因上市公司分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起36个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。
倍瑞诗、伊斯源因本次发行股份购买资产而获得上市公司的股份(包括在股份锁定期内因上市公司分配股票股利、资本公积转增等衍生取得的股份),自本次股份发行完成之日起12个月内不得转让,包括但不限于通过证券市场公开转让或通过协议转让。
若上述锁定股份的承诺与证券监管部门的最新监管意见不符的,将按照《证券法》等相关法律法规的规定及相关证券监管部门的最新监管意见锁定。
业绩承诺期内,如前述锁定期届满后,交易对方持有的上市公司向其定向增发的前述股份将继续锁定并按业绩承诺期内各年度业绩累计完成情况分批解锁,各期可解锁股份数量如下:当期可解锁股份数量=上市公司向交易对方定向发行股份数量*截至当期期末累计实现的调整净利润/交易对方于业绩承诺期内承诺的调整净利润总额-累计已经解锁股份,在业绩承诺期结束后,如未达到合计承诺调整净利润但交易对方已经履行完毕全部补偿义务后解锁所有股份。
本次发行完成后,由于上市公司送红股、转增股本等原因而孳息的上市公司股份,亦遵照上述锁定期进行锁定。锁定期届满之后股份的交易按照中国证监会及深交所的有关规定执行。
交易对方因本次交易而获得的股份在锁定期届满后减持还需遵守届时应遵守的法律、深交所相关规则以及上市公司《公司章程》的规定。
如根据中国证监会与深交所有关重大资产重组所涉股份锁定之规定和要求,
2-2-292
上述解锁日尚不符合该等规定和要求的,应自满足该等规定和要求后15个工作日内办理解锁手续。
2、关于业绩补偿义务人质押对价股份的安排
根据中国证监会《关于业绩承诺方质押对价股份的相关问题与解答》规定,“上市公司重大资产重组中,交易对方拟就业绩承诺作出股份补偿安排的,应当确保相关股份能够切实用于履行补偿义务。如业绩承诺方拟在承诺期内质押重组中获得的、约定用于承担业绩补偿义务的股份(以下简称“对价股份”),重组报告书(草案)应当载明业绩承诺方保障业绩补偿实现的具体安排”,根据上述规定,发行股份及支付现金购买资产的交易对方已出具《关于对价股份质押事宜的承诺函》,承诺如下:
“1、本人/本公司同意,如果标的公司在承诺期累计实现的调整净利润数(合并报表中经审计扣除非经常性损益后归属于母公司(唯德康医疗)股东的净利润,加上计入经常性损益的当期股份支付费用后的数额)低于承诺期调整净利润承诺总数的,则本人/本公司应当按照《业绩补偿协议》及《业绩补偿协议之补充协议》约定向上市公司进行足额补偿。本人/本公司应优先以在本次交易中取得的上市公司股份进行补偿,所持股份不足以补偿的,应由本人/本公司以现金方式予以补足。本人/本公司与其他交易方按照本次交易中各自出让的标的公司股权的相对比例分担,并互相承担连带责任。
2、本人/本公司承诺本人/本公司于本次交易中获得的上市公司股份(以下简称“对价股份”)优先用于履行上述业绩补偿义务,不通过质押股份等方式逃避该等补偿义务;未来质押对价股份时,将书面告知质权人相关股份具有潜在业绩补偿义务情况,并在质押协议中就相关股份用于支付业绩补偿事项等与质权人作出明确约定。”
综上,独立财务顾问认为:上市公司已经与交易对方就业绩补偿签订了明确可执行的补偿安排,相关补偿安排具备可行性、合理性。
十四、关于本次交易摊薄即期回报情况及填补措施的核查
(一)本次交易对上市公司每股收益的影响
根据上市公司未经审计的2021年1-6月财务报表、经审计的2020年财务报
2-2-293
表以及经审阅的备考财务报表,上市公司最近一年一期主要财务指标比较如下:
| 项目 | 2021年6月30日/2021年1-6月 | 2020年12月31日/2020年度 | ||
| 未审数 | 备考数 | 审定数 | 备考数 | |
| 基本每股收益(元/股) | 0.28 | 0.28 | 0.78 | 0.79 |
| 基本每股收益(扣非后)(元/股) | 0.27 | 0.29 | 0.72 | 0.74 |
| 归属于上市公司股东的每股净资产(元/股) | 3.34 | 3.68 | 3.26 | 3.51 |
本次交易前,上市公司2021年1-6月基本每股收益为0.28元/股,基本每股收益(扣非后)为0.27元/股;本次交易完成后,上市公司2021年1-6月备考基本每股收益为0.28元/股,备考基本每股收益(扣非后)为0.29元/股,从基本每股收益来看,除去四舍五入的因素,本次交易前,上市公司2021年1-6月基本每股收益为0.2835元/股,本次交易后,上市公司2021年1-6月备考基本每股收益为0.2787元/股,短期内上市公司2021年1-6月基本每股收益被摊薄,主要原因系标的公司于2021年3月内部重组时因非同比例增资导致一次性确认了3,616.67万元计入非经常性损益的股份支付费用,扣除该等非经常性损益因素后,备考基本每股收益(扣非后)有所上升,本次交易总体上有利于增强上市公司的盈利能力。
上述财务指标证明标的公司具备较强的盈利能力,本次交易完成后将有助于提高上市公司每股净资产,符合上市公司全体股东的利益。
(二)本次交易摊薄即期回报的填补措施
由于标的公司未来盈利受到国家政策、市场竞争格局、公司经营状况等多方面因素的影响,存在一定的不确定性。为进一步降低本次交易可能导致的对上市公司每股收益的摊薄,上市公司拟采取多种措施提高对股东的即期回报,具体如下:
(一)加快标的资产整合,提升公司的盈利能力
本次交易完成后,上市公司将积极推进对标的公司的整合,上市公司在消化道诊疗领域的布局将更加完善和多元化,拓展在细分领域内的影响力,进一步丰富产品管线,拓展销售渠道,加速产品的商业化进程,进而提升上市公司的持续盈利能力。
2-2-294
(二)积极加强经营管理,提升公司经营效率
目前公司已制定了较为完善、健全的经营管理制度,保证了公司各项经营活动的正常有序进行。公司未来将进一步提高经营和管理水平,完善并强化投资决策程序,加强成本管理,优化预算管理流程,强化执行监督,全面有效地提升公司经营效率。
(三)健全内部控制体系,为公司发展提供制度保障
公司严格遵循《中华人民共和国公司法》《中华人民共和国证券法》《上市公司治理准则》等法律、法规和规范性文件的要求,不断完善和优化公司法人治理结构,健全和执行公司内部控制体系,规范公司运作。本次交易完成后,公司将进一步完善治理结构,确保股东能够充分行使权利;确保董事会能够按照法律、法规以及公司章程的规定行使职权,做出科学、迅速和谨慎的决策;确保独立董事能够认真履行职责,维护公司整体利益,尤其是中小股东的合法权益,为公司发展提供制度保障。
(四)严格执行利润分配政策,强化投资者回报机制
本次交易完成后,公司将根据中国证券监督管理委员会《上市公司监管指引第3号——上市公司现金分红》及《关于进一步落实上市公司现金分红有关事项的通知》等法律、法规及规范性文件的相关规定,并遵循公司章程中关于利润分配的规定,继续实行持续、稳定、积极的利润分配政策,同时结合公司实际情况和投资者意愿,广泛听取独立董事、中小股东的意见和建议。公司将持续完善公司利润分配政策并更加明确对股东回报的合理规划,强化中小投资者权益保障机制,重视提高现金分红水平,强化投资者回报机制并给予投资者合理回报。
(三)上市公司控股股东、实际控制人及一致行动人关于保证公司填补被摊薄即期回报措施切实履行的承诺函
为保证上市公司本次交易摊薄即期回报的相关填补措施能够得到切实履行,上市公司控股股东、实际控制人及一致行动人作出以下承诺:
“1、本公司/本人不越权干预上市公司经营管理活动,不侵占上市公司利益。
2、本公司/本人承诺切实履行上市公司制定的有关填补回报措施以及本公司
2-2-295
/本人对此作出的任何有关填补回报措施的承诺,若本公司/本人违反该等承诺并给上市公司或者投资者造成损失的,本公司/本人愿意依法承担对上市公司或者投资者的补偿责任。
3、自本承诺出具日至上市公司本次交易实施完毕前,若中国证监会作出关于填补回报措施及其承诺的其他新的监管规定的,且上述承诺不能满足中国证监会该等规定时,本公司/本人承诺届时将按照中国证监会的最新规定出具补充承诺。”
(四)上市公司全体董事、高级管理人员关于保证公司填补被摊薄即期回报措施切实履行的承诺函
为保证上市公司本次交易摊薄即期回报的相关填补措施能够得到切实履行,上市公司全体董事、高级管理人员作出以下承诺:
“1、本人承诺不无偿或以不公平条件向其他单位或者个人输送利益,也不采用其他方式损害公司利益。
2、本人承诺对本人的职务消费行为进行约束。
3、本人承诺不动用公司资产从事与其履行职责无关的投资、消费活动。
4、本人承诺由董事会或薪酬委员会制定的薪酬制度与公司填补回报措施的执行情况相挂钩。
5、若公司未来实施股权激励,本人承诺公司股权激励的行权条件将与公司填补回报措施的执行情况相挂钩。
6、本承诺出具日后至本次交易完毕前,中国证监会作出关于填补回报措施及其承诺明确规定时,且上述承诺不能满足中国证监会该等规定时,本人承诺届时将按照中国证监会规定出具补充承诺。
7、本人承诺切实履行公司制定的有关填补回报措施以及本人对此作出的任何有关填补回报措施的承诺,若本人违反该等承诺并给公司或者投资者造成损失的,本人愿意依法承担对公司或者投资者的补偿责任。
8、作为填补回报措施相关责任主体之一,本人若违反上述承诺或拒不履行上述承诺,本人同意按照中国证监会和深圳证券交易所等证券监管机构按照其制
2-2-296
定或发布的有关规定、规则,对本人作出处罚或采取相关管理措施。”
综上,独立财务顾问认为:上市公司就本次交易可能摊薄即期回报的风险进行了披露,上市公司拟采取的填补即期回报措施切实可行,上市公司控股股东/实际控制人、董事、高级管理人员根据中国证监会相关规定,对公司填补回报措施能够得到切实履行作出了承诺,符合《国务院办公厅关于进一步加强资本市场中小投资者合法权益保护工作的意见》(国办发[2013]110号)等相关法律、法规和规范性文件的规定,有利于保护中小投资者的合法权益。
十五、本次交易符合《重组管理办法》第三条有关拟购买资产存在资金占用问题的适用意见——证券期货法律适用意见第10号
截至本独立财务顾问报告出具日,本次交易拟购买资产的股东及其关联方、资产所有人及其关联方不存在对拟购买资产的非经营性资金占用的情况。
经核查,本独立财务顾问认为,本次交易符合《重组管理办法》第三条有关拟购买资产存在资金占用问题的适用意见——证券期货法律适用意见第10号的规定。
十六、关于相关主体是否存在有偿聘请第三方行为的核查
(一)本次交易中独立财务顾问聘请第三方情况的核查
本次交易中,独立财务顾问不存在直接或间接有偿聘请第三方的行为。
(二)本次交易中上市公司聘请第三方情况的核查
根据上市公司出具的说明并经核查,上市公司除聘请独立财务顾问、律师事务所、会计师事务所、资产评估机构以外,不存在直接或间接有偿聘请其他第三方的行为,符合《关于加强证券公司在投资银行类业务中聘请第三方等廉洁从业风险防控的意见》的相关规定。
经核查,本独立财务顾问认为:本次交易中独立财务顾问不存在直接或间接有偿聘请第三方的行为;上市公司除聘请独立财务顾问、律师事务所、会计师事务所、资产评估机构以外,不存在直接或间接有偿聘请其他第三方的行为,符合《关于加强证券公司在投资银行类业务中聘请第三方等廉洁从业风险防控的意见》的相关规定。
2-2-297
第九节 独立财务顾问内核程序及内部审核意见
一、独立财务顾问内核程序
华泰联合证券已根据相关监管制度和配套法规的要求建立健全了规范、有效的投行业务项目申请文件质量控制体系和投资银行业务内控制度,制定并严格遵循《华泰联合证券有限责任公司并购重组项目管理办法》《华泰联合证券有限责任公司并购重组业务立项、内核管理办法》,具体的内部审核程序如下:
1、项目小组根据项目具体情况,按照规定将申报文件准备完毕,并经所在业务部门初步审核后,向质量控制部提出内核申请;
2、提交的申请文件经受理后,质量控制部根据监管机构的相关规定,对申请材料的完整性、合规性及文字格式等内容做审查,并通过现场检查程序对项目小组是否勤勉尽责进行核查,并向项目小组提出预审意见,项目小组对预审意见做出专项回复及说明;
3、合规与风险管理部组织项目问核,由财务顾问主办人、质量控制部的审核人员参与问核工作;
4、质量控制部审核人员对项目小组预审意见回复进行审阅,并对工作底稿进行验收,通过后,由质量控制部审核人员出具质量控制报告,后续由合规与风险管理部组织并购重组业务内核评审会议,内核评审小组委员以书面表决方式对项目进行投票。根据投票结果,本项目通过内核会议评审。根据内核会议对项目小组提出的反馈问题,项目小组做出专项回复及说明;经质量控制部、合规与风险管理部审阅并认可后,经公司领导审批通过完成内核程序。
二、独立财务顾问内核意见
华泰联合证券内核小组成员认真阅读《北京奥赛康药业股份有限公司发行股份及支付现金购买资产报告书(草案)》及本独立财务顾问报告的基础上,内核小组组长召集并主持内核会议,内核意见如下:
“你组提交的北京奥赛康药业股份有限公司发行股份及支付现金购买资产项目内核申请,经过本次会议议论、表决,获通过。”
2-2-298
综上所述,本独立财务顾问同意为北京奥赛康药业股份有限公司发行股份及支付现金购买资产项目出具独立财务顾问报告并向深交所及相关证券监管部门报送相关申请文件。
2-2-299
第十节 独立财务顾问结论意见根据《中华人民共和国公司法》《中华人民共和国证券法》《上市公司重大资产重组管理办法》《关于规范上市公司重大资产重组若干问题的规定》《公开发行证券的公司信息披露准则第26号——上市公司重大资产重组申请文件》《上市公司并购重组财务顾问业务管理办法》等法律法规之规定,独立财务顾问对奥赛康董事会编制的《北京奥赛康药业股份有限公司发行股份及支付现金购买资产交易报告书(草案)》以及相关材料进行了审慎核查后,发表独立财务顾问结论性意见如下认为:
1、本次交易遵守了国家相关法律、法规的要求,履行了必要的信息披露程序,符合《公司法》《证券法》《重组管理办法》《关于规范上市公司重大资产重组若干问题的规定》等有关法律、法规的规定,已取得现阶段必要的批准和授权,并履行了必要的信息披露程序;
2、本次交易符合国家相关产业政策,符合环境保护、土地管理、反垄断等法律和行政法规的相关规定;
3、本次交易完成后,不会导致上市公司不符合股票上市条件;
4、本次交易涉及的资产权属清晰,在相关法律程序和先决条件得到适当履行的情形下,资产过户或者转移不存在实质性障碍,相关债权债务处理合法;
5、本次交易完成后,上市公司将继续保持健全有效的法人治理结构,在业务、资产、人员、机构、财务等方面与控股股东及关联方保持独立,符合中国证监会关于上市公司独立性的相关规定;
6、本次交易前后,上市公司实际控制权未发生变更,不构成《重组管理办法》第十三条所规定的重组上市的情形;
7、本次交易完成后,上市公司将持有标的公司60%股权,本次交易完成后有利于提高上市公司资产质量、改善上市公司财务状况和增强持续盈利能力,本次交易有利于上市公司的持续发展、有利于保护上市公司全体股东的利益;
8、本次交易价格根据符合《证券法》要求的评估机构的评估结果并经交易各方协商确定,定价公平、合理。本次发行股份及支付现金购买资产的股份发行
2-2-300
定价符合《重组管理办法》的相关规定。本次交易涉及资产评估的评估假设前提合理,方法选择适当,结论具备公允性;
9、本次交易所涉及的各项合同内容合法,在交易各方履行本次交易相关协议的情况下,不存在上市公司发行股票后不能及时获得相应对价的情形;
10、本次交易前,交易对方与上市公司不存在关联关系,本次交易完成后,各交易对方持有上市公司股份均低于5%,本次交易不构成关联交易;
11、本次交易对方与上市公司就相关资产实际盈利数不足业绩承诺数情况的补偿安排切实可行、合理;
12、本次交易的交易对方不存在对拟购买资产的非经营性资金占用的情况;
13、在本次交易中独立财务顾问未聘请第三方,上市公司除依法需聘请独立财务顾问、律师事务所、会计师事务所、资产评估机构外,不存在直接或间接有偿聘请其他第三方的行为,符合中国证监会《关于加强证券公司在投资银行类业务中聘请第三方等廉洁从业风险防控的意见》的相关规定。
2-2-301
(本页无正文,为《华泰联合证券有限责任公司关于北京奥赛康药业股份有限公司发行股份及支付现金购买资产交易之独立财务顾问报告》之签署页)
项目协办人:
任雅静 蓝图 刁贵军财务顾问主办人:
徐妍薇 季李华投行业务负责人:
唐松华内核负责人:
邵年法定代表人:
江禹
华泰联合证券有限责任公司
年 月 日