证券代码:300147 证券简称:香雪制药 公告编号:2019-108
广州市香雪制药股份有限公司关于股价异动及风险提示的公告
本公司及董事会全体成员保证信息披露的内容真实、准确、完整,没有虚假记载、误导性陈述或重大遗漏。
特别风险提示:
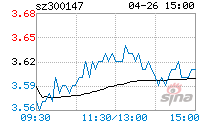
1、广州市香雪制药股份有限公司(以下简称“公司”)股票交易价格连续三个交易日收盘价格涨幅偏离值累计超过20%,达到了深圳证券交易所相关规则规定的异常波动标准。
2、近日,公司与ATHENEX,INC.(以下简称“Athenex”)签署了《授权协议》,公司与Athenex就在研产品口服紫杉醇、口服伊立替康和KX2-391软膏的研发、商业化进行合作,具体内容详见公司于2019年12月16日在中国证监会指定的创业板信息披露网站披露的《关于公司与ATHENEX,INC.签署授权协议及相关事项的公告》(公告编号:2019-106),《授权协议》尚需经公司完成技术尽职调查且对尽职调查结果满意、并经公司与Athenex各自的内部有效审批程序审议通过及监管部门审批通过之后方可生效,截止目前,公司正在进行技术尽职调查的准备工作。 3、公司充分认识到上述合作项目在政策审批、产品研发、后续投入加大及商业化推广不达预期、市场环境等多方面的风险,敬请广大投资者注意二级市场投资风险,理性投资。
一、股票交易异常波动情况的说明
公司股票价格于2019年12月17日、18日、19日连续三个交易日收盘价格涨幅偏离值累计超过20%,根据深圳证券交易所的有关规定属于股票交易异常波
动的情况。
二、公司关注并核实情况
对公司股价异常波动,公司通过电话及现场问询方式,对持股5%以上股东、董事、监事及高级管理人员就相关问题进行了核实,现将核实情况公告如下:
1、近期公司经营情况及内外部经营环境未发生重大变化;
2、公司存在进展中的事项,已按规定披露:
公司第八届董事会第九次会议审议通过了《关于公司与ATHENEX,INC.签署授权协议及相关事项的议案》,公司与Athenex在研产品口服紫杉醇、口服伊立替康和KX2-391软膏的研发、商业化进行合作。具体内容详见公司于2019年12月16日在中国证监会指定的创业板信息披露网站披露的《关于公司与ATHENEX,INC.签署授权协议及相关事项的公告》(公告编号:2019-106)。截止目前,除上述公告外公司方面尚无需要披露的关于该项目的进展信息。
3、公司前期披露的信息不存在需要更正、补充之处;
4、公司及公司持股 5%以上股东不存在关于本公司的应披露而未披露的重大事项,或处于筹划阶段的重大事项;
5、公司未发现近期公共媒体报道了可能或已经对本公司股票交易价格产生较大影响的未公开重大信息;
6、股票异动期间,公司持股 5%以上股东、董事、监事及高级管理人员未发生在二级市场买卖公司股票的行为;
7、公司不存在违反公平信息披露规定的其他情形。
三、是否存在应披露而未披露的说明
公司董事会确认,公司目前没有任何根据《深圳证券交易所创业板股票上市规则》等有关规定应予以披露而未披露的事项;董事会也未获悉公司根据《深圳证券交易所创业板股票上市规则》有关规定应予以披露而未披露的、对公司股票及其衍生品种交易价格产生较大影响的信息。
四、风险提示
截止本公告披露之日,《授权协议》尚需经公司完成技术尽职调查且对尽职
调查结果满意,并经公司与Athenex各自的内部有效审批程序审议通过及监管部门审批通过之后方可生效,截止目前,公司正在进行技术尽职调查的准备工作。公司郑重提醒投资者再次关注公司与Athenex合作事项以下的风险因素:
(一)政策和审批风险
协议签订后,由于境外政策、法律制度、商业环境、文化等方面与国内存在差异,市场、政治、经济、技术等存在不可预测或不可抗力等因素的影响,在未来的经营管理过程中可能存在上市取得批准、投入生产及销售等审批风险和挑战。同时本次交易尚需完成技术尽职调查、并经公司与Athenex各自的内部有效审批程序审议通过及监管部门审批通过之后生效,存在一定的政策和审批风险。
(二)产品研发风险
口服紫杉醇用于治疗转移性乳腺癌已完成III期临床试验,研究资料整理后方可向美国FDA申请新药上市批准;口服伊立替康用于治疗大肠癌等实体瘤的适应症已完成I期临床试验,即将进入II期临床试验阶段;KX2-391软膏用于治疗光化性角化病的适应症已完成III期临床试验,研究资料整理后方可向美国FDA申请新药上市批准。该等临床试验结果能否达到预期目标,以及产品能否获得美国FDA的最终上市批准,都存在不确定性。根据国内外新药研发经验,新药研发均存在一定风险,例如I期、II期和/或III期(如适用)临床试验中均可能会因为安全性和/或有效性等问题而终止。
(三)产品研发失败导致款项无法收回的风险
即便授权产品能够获得美国FDA批准在美国上市,于授权区域内能否获得监管机构(包括但不限于国家食药监总局)批准上市仍存在不确定。如公司对授权产品在授权区域内的研发及商业化未能按协议约定取得相关权益及进展,触及了协议约定的违约责任及赔偿条款,公司前期支付的预付款及相关费用存在无法收回的风险,且公司后续为推进药品上市所必要支出包括研发投入、组织生产投入、销售投入,存在因研发失败导致前述相关投入无法收回的风险。
(四)后续投入加大及商业化推广不达预期风险
新药研发是项长期工作且新药上市后的销售情况受包括市场环境、行业发展
等在内的诸多因素影响,虽然Athenex在授权区域内承担一定的临床研究费用,但是后续研发支出及生产投入成本会继续加大,给公司会带来一定的压力,同时授权产品的即使未来双方合作开发在国内取得成功获得上市许可,后续商业化推广能否取得预期效益,仍存在不确定性。经自查,公司不存在违反信息公平披露的情形,公司指定的信息披露媒体为《中国证券报》、《证券时报》和巨潮资讯网(http://www.cninfo.com.cn),公司所有信息均以在上述指定媒体刊登的信息为准。公司将持续跟进事项的进展情况,并根据《深圳证券交易所创业板股票上市规则》及《公司章程》等相关规定及时披露相关进展,敬请广大投资者注意二级市场投资风险,理性投资。
特此公告。
广州市香雪制药股份有限公司董事会2019年12月19日